EDARBI CLD
Estás aquí
Contáctanos

Tabletas
Fórmula:
Cada tableta contiene:
Azilsartán medoxomilo de potasio........ 42.68 mg 85.36 mg 42.68 mg
Equivalente a......................................... 40 mg 80 mg 40 mg
de azilsartán medoxomilo
Clortalidona........................................... 12.5 mg 12.5 mg 25 mg
EDARBI CLD® contiene un bloqueador de receptores de la angiotensina II (angiotensin II receptor blocker, ARB) y un diurético similar a la tiazida. EDARBI CLD® está indicado para el tratamiento de la hipertensión moderada a grave, pues disminuye la presión arterial. EDARBI CLD® se puede usar como terapia inicial en caso de que el paciente necesite varios fármacos para lograr el control de la presión arterial.
Existe evidencia de que el uso concomitante de inhibidores de la enzima convertidora de angiotensina, bloqueadores del receptor de angiotensina II o de productos que contienen aliskireno, incrementa el riesgo de hipotensión, hipercalemia y disminuye la función renal (incluyendo falla renal aguda). No se recomienda el bloqueo simultáneo del sistema renina angiotensina aldosterona a través del uso combinado de inhibidores de la enzima convertidora de angiotensina, bloqueadores del receptor de angiotensina II o de productos que contienen aliskireno.
La elección de EDARBI CLD® como terapia inicial para la hipertensión se debe basar en una evaluación de los beneficios y riesgos potenciales, incluyendo si es probable que el paciente tolere la dosis inicial de EDARBI CLD®.
Los pacientes con hipertensión moderada a grave tienen un riesgo relativamente alto de sufrir problemas cardiovasculares (p. ej., accidente cerebrovascular, ataque cardiaco e insuficiencia cardiaca), insuficiencia renal y problemas de la vista, por lo que el tratamiento oportuno es clínicamente relevante. Considere la presión arterial inicial del paciente, el valor objetivo y la probabilidad gradual de alcanzar el valor objetivo con un producto combinado, como EDARBI CLD®, en comparación con un producto de monoterapia, al decidir sobre la terapia inicial con EDARBI CLD®.
Los datos de un ensayo factorial de 8 semanas con control activo, ofrecen estimaciones sobre la probabilidad de alcanzar una presión arterial objetivo con EDARBI CLD®, en comparación con la monoterapia con azilsartán medoxomilo o clortalidona.
Las Figuras 1.a-1.d proporcionan estimaciones de la probabilidad de alcanzar el control clínico de la presión arterial sistólica y diastólica objetivo con tabletas de EDARBI CLD® 40/12.5 mg después de 8 semanas, con base en la presión arterial sistólica o diastólica inicial.
La curva para cada grupo de tratamiento se calculó mediante modelos de regresión logística y es más variable en los extremos.
Figura 1.a Probabilidad de lograr una presión arterial sistólica <140 mm Hg en la semana 8
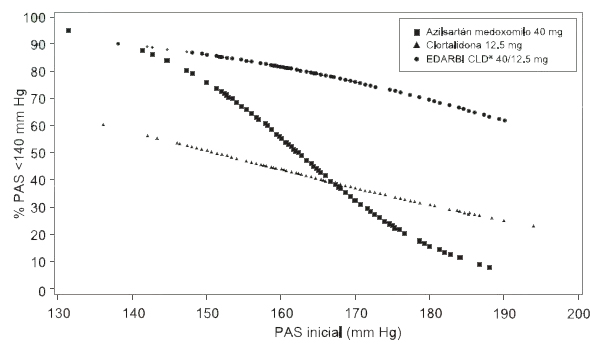
Figura 1.b Probabilidad de lograr presión arterial sistólica <130 mm Hg en la semana 8
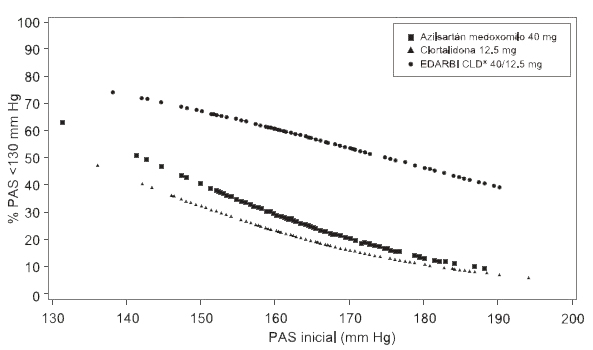
Figura 1.c Probabilidad de lograr presión arterial diastólica <90 mm Hg en la semana 8
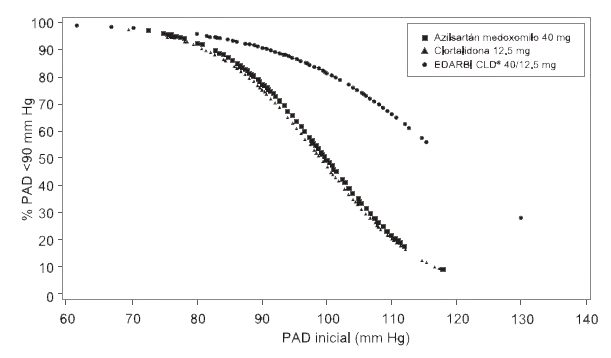
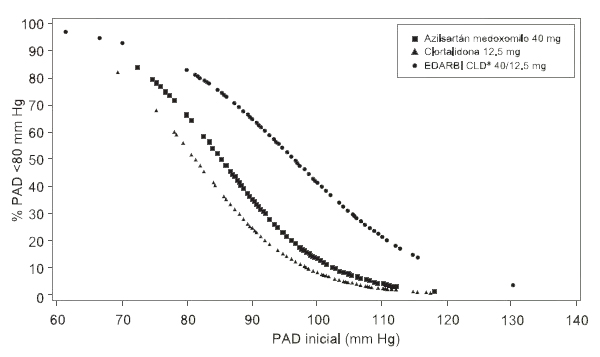
Figura 1.d Probabilidad de lograr presión arterial diastólica <80 mm Hg en la semana 8
Por ejemplo, un paciente con presión arterial inicial de 160/100 mm Hg tiene una probabilidad aproximada de 55% de alcanzar un objetivo de <140 mm Hg (sistólica) y una probabilidad de 49% de alcanzar <90 mm Hg (diastólica) con azilsartán medoxomilo de 40 mg. Las probabilidades de alcanzar estos mismos objetivos con clortalidona de 12.5 mg son de aproximadamente 44% (sistólica) y 47% (diastólica). Estas probabilidades aumentan a 82% (sistólica) y 81% (diastólica) con EDARBI CLD® 40/12.5 mg.
- Hipersensibilidad a cualquiera de los componentes de la tableta de EDARBI CLD®.
- Anuria.
- Embarazo.
- Hiponatremia refractaria.
- Pacientes con diabetes que estén en tratamiento con aliskireno.
Experiencia en ensayos clínicos
Como los ensayos clínicos se realizan en condiciones muy variadas, no es posible comparar directamente las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco con las tasas observadas en los ensayos clínicos de otro fármaco, y es posible que no reflejen las tasas observadas en la práctica.
La seguridad de EDARBI CLD® ha sido evaluada en más de 3,900 pacientes con hipertensión; más de 700 pacientes fueron tratados durante al menos 6 meses, y más de 280 durante al menos 1 año. En general, las reacciones adversas han sido leves y de naturaleza transitoria.
Las reacciones adversas comunes que ocurrieron en el ensayo de diseño factorial en al menos 2% de los pacientes tratados con EDARBI CLD®, y mayores que las ocurridas con azilsartán medoxomilo o clortalidona, se presentan en la Tabla 1.
Tabla 1. Reacciones adversas que ocurrieron con una incidencia ≥2% de los pacientes tratados con EDARBI CLD® y > azilsartán medoxomilo o clortalidona
|
Término preferido |
Azilsartán medoxomilo 20, 40, 80 mg (N=470) |
Clortalidona 12.5, 25 mg (N=316) |
EDARBI CLD® 20/12.5, 40/12.5, 80/12.5, 40/25 mg (N=611) |
|
Mareos |
1.7% |
1.9% |
8.2% |
|
Fatiga |
0.6% |
1.3% |
2.5% |
Se tienen informes de hipotensión y síncope en 1.3% y 0.3%, respectivamente, de los pacientes tratados con aaa CLD®.
La interrupción debida a eventos adversos ocurrió en 7.5% de los pacientes tratados con las dosis recomendadas de EDARBI CLD®, en comparación con 3.2% de los pacientes tratados con azilsartán medoxomilo y 3.2% de los pacientes tratados con clortalidona. La razón más común de la interrupción del tratamiento con EDARBI CLD® fue el aumento de la creatinina en sangre.
A continuación, se enumeran otras reacciones adversas, posiblemente relacionadas con el tratamiento, de las que se tienen informes con incidencia ≥0.3% en más de 2,660 pacientes tratados con EDARBI CLD® en ensayos aleatorizados, doble ciegos aleatorizados:
Trastornos de la sangre y el sistema linfático: anemia.
Trastornos cardiacos: palpitaciones, taquicardia.
Trastornos del oído y el laberinto: vértigo.
Trastornos oculares: visión borrosa.
Trastornos gastrointestinales: molestia abdominal, dolor abdominal superior, estreñimiento, diarrea, boca seca, dispepsia, náuseas, vómitos.
Trastornos generales y afecciones en el lugar de administración: astenia, dolor de pecho, edema periférico.
Trastornos del metabolismo y la nutrición: hipercalemia, hiponatremia, hiperuricemia.
Trastornos de los tejidos musculoesquelético y conectivo: artralgia, espasmos musculares, dolor en las extremidades.
Trastornos del sistema nervioso: mareos posturales, dolor de cabeza, somnolencia.
Trastornos renales y urinarios: disfunción renal.
Trastornos del aparato reproductivo y los senos: disfunción eréctil. Trastornos respiratorios, torácicos y del mediastino: tos, disnea. Trastornos de la piel y el tejido subcutáneo: hiperhidrosis.
Trastornos vasculares: hipotensión ortostática.
El perfil de reacciones adversas obtenido de 52 semanas de terapia combinada de etiqueta abierta con azilsartán medoxomilo más clortalidona o EDARBI CLD®, fue similar al observado durante los ensayos controlados doble ciego.
En 3 estudios de titulación doble ciego con control activo, en los que EDARBI CLD® se tituló en dosis mayores de manera gradual, las reacciones adversas y las interrupciones por eventos adversos fueron menos frecuentes que en el ensayo factorial de dosis fija.
Azilsartán medoximilo
Se evaluó a un total de 4,814 pacientes en cuanto a seguridad, al tratarlos con azilsartán medoxomilo en dosis de 20, 40 u 80 mg en ensayos clínicos. Esto incluye a 1,704 pacientes tratados durante al menos 6 meses, de estos, 588 fueron tratados durante al menos 1 año. El tratamiento con azilsartán medoxomilo fue bien tolerado, con una incidencia general de reacciones adversas similar al placebo. En general, las reacciones adversas fueron leves, no relacionadas con la dosis y similares, independientemente de la edad, el sexo y la raza.
A continuación, se enumeran otras reacciones adversas con posible relación con el tratamiento, de las cuales se tienen informes con una incidencia de ≥0.3% y superior al placebo en más de 3,300 pacientes tratados con azilsartán medoxomilo en ensayos controlados:
Trastornos gastrointestinales: náuseas.
Trastornos generales y afecciones en el lugar de administración: astenia, fatiga.
Trastornos de los tejidos musculoesquelético y conectivo: espasmo muscular.
Trastornos del sistema nervioso: mareos, mareos posturales.
Trastornos respiratorios, torácicos y del mediastino: tos.
Clortalidona
Se han observado las siguientes reacciones adversas, pero no se han recopilado datos sistemáticos suficientes para apoyar una estimación de su frecuencia.
Reacciones del sistema gastrointestinal: anorexia, irritación gástrica, náuseas, vómitos, retortijones, diarrea, estreñimiento, ictericia (ictericia colestática intrahepática), pancreatitis.
Reacciones del sistema nervioso central: mareos, vértigo, parestesias, dolor de cabeza, xantopsia.
Reacciones hematológicas: leucopenia, agranulocitosis, trombocitopenia, anemia aplásica.
Reacciones de hipersensibilidad dermatológica: púrpura, fotosensibilidad, urticaria por sarpullido, angeítis necrotizante (vasculitis, vasculitis cutánea), síndrome de Lyell (necrólisis epidérmica tóxica).
Reacciones cardiovasculares: hipotensión ortostática.
Otras reacciones adversas: hiperglucemia, glucosuria, hiperuricemia, espasmo muscular, debilidad, inquietud, impotencia.
Para EDARBI CLD® se han reportado las siguientes reacciones adversas posteriores a la comercialización:
Desórdenes gastrointestinales:
- Náusea.
Desórdenes del sistema nervioso:
- Síncope.
- Pérdida de conciencia.
Desórdenes de la piel y del tejido subcutáneo:
- Sarpullido.
- Prurito.
- Angioedema.
Hallazgos de laboratorio clínico
EDARBI CLD®
En el ensayo factorial de diseño, los cambios clínicamente relevantes en los parámetros estándar de laboratorio fueron poco comunes con la administración de las dosis recomendadas de EDARBI CLD®.
Parámetros renales:
El aumento de la creatinina en sangre es un efecto farmacológico conocido de los bloqueadores del sistema renina-angiotensina-aldosterona (renin-angiotensin aldosterone system, RAAS), como los ARB y los inhibidores de las ACE, en congruencia con la magnitud de la reducción de la presión arterial. La incidencia de aumentos consecutivos de la creatinina ≥50% respecto al valor inicial y >ULN (límite superior de lo normal) fue de 1.7% en los pacientes tratados con las dosis recomendadas de EDARBI CLD®, en comparación con 0.4% y 0.3% con azilsartán medoxomilo y clortalidona, respectivamente. Las elevaciones de la creatinina fueron típicamente pasajeras, o no progresivas y reversibles, y estuvieron asociadas a grandes reducciones de la presión arterial.
Se observaron aumentos medios en el nitrógeno ureico en sangre (blood urea nitrogen, BUN) con EDARBI CLD® (4.8 mg/dl) en comparación con la clortalidona (2.5 mg/dl) y azilsartán medoxomilo (1.5 mg/dl).
Se observaron disminuciones medias en la proporción albúmina urinaria/creatinina con EDARBI CLD®, clortalidona y azilsartán medoxomilo.
Potasio: en los pacientes con niveles normales de potasio al inicio, 1.7% de los pacientes tratados con EDARBI CLD®, 0.9% de los pacientes tratados con azilsartán medoxomilo y 13.4% de los pacientes tratados con clortalidona, comenzaron a tener niveles bajos de potasio (menos de 3.4 mmol/l). La hipopotasemia es una reacción adversa conocida, dependiente de la dosis, de los diuréticos, incluso la clortalidona; la mayor incidencia de la hipopotasemia se observó con la clortalidona (7.3%), pero fue inferior al combinarla con azilsartán medoxomilo en EDARBI CLD® (1.1%).
Otros electrolitos: se observaron pequeñas disminuciones medias en el sodio sérico. No hubo cambios clínicamente significativos, ni en el magnesio ni en el calcio.
Hemoglobina/hematocrito: se observaron recuentos bajos de hemoglobina, hematocrito y glóbulos rojos en ≤ 1.0%, ≤ 0.2% y en ninguno de los pacientes tratados con EDARBI CLD®, azilsartán medoxomilo y clortalidona, respectivamente. Se observaron recuentos bajos y altos marcadamente anormales de plaquetas y glóbulos blancos en ≤ 0.3% de los pacientes.
Pruebas de función hepática: las elevaciones de enzimas hepáticas no fueron algo común.
Indicadores metabólicos: se observaron aumentos medios en ácido úrico, triglicéridos y glucosa. No hubo cambios clínicamente significativos ni en el colesterol HDL ni en el LDL.
Asimismo, se tuvieron informes de las siguientes anomalías de laboratorio, como reacciones adversas en ≥0.3% de los sujetos: aumento de alanina aminotransferasa, aumento de aspartato aminotransferasa, disminución de cloruros en sangre, aumento de creatina fosfocinasa en sangre, aumento de creatinina en sangre, aumento de glucemia, disminución y aumento de potasio en sangre, disminución de sodio en sangre, aumento de urea en sangre, aumento de ácido úrico en sangre, aumento de gamma glutamiltransferasa.
Frasco con 7, 14 o 28 tabletas de 40/12.5 mg, 80/12.5 mg
Caja de cartón con envase burbuja que contiene 7, 14 o 28 tabletas, de 40/12.5 mg, 80/12.5 mg o 40/25 mg.
Consideraciones generales
La dosis inicial habitual de EDARBI CLD® es de 20/12.5 mg o 40/12.5 mg, tomada por vía oral una vez al día (cada 24 horas). La mayor parte del efecto antihipertensivo es evidente en 1-2 semanas y, por consiguiente, es posible aumentar la dosis después de 2-4 semanas, según sea necesario, para controlar la presión arterial. La dosis máxima eficaz de EDARBI CLD® es de 40/25 mg.
EDARBI CLD® se puede tomar con o sin alimentos.
EDARBI CLD® se puede administrar con otros agentes antihipertensivos si fuera necesario reducir más la presión arterial.
Terapia inicial
EDARBI CLD® se puede utilizar como terapia inicial si es poco probable que se logre controlar la presión arterial con un solo fármaco.
Terapia adjunta o de cambio
EDARBI CLD® se puede usar para reducir aún más la presión arterial en el caso de pacientes en los que no se logra un control adecuado con las dosis máximas toleradas, etiquetadas o habituales de ARB o diuréticos.
Si un paciente experimenta reacciones adversas limitantes de la dosis con cualquier componente por sí solo (p. ej., hipopotasemia con clortalidona 25 mg o más alta) es posible cambiarlo a EDARBI CLD® con una dosis más baja de este componente para lograr reducciones de la presión arterial similares o mayores.
Poblaciones especiales
Pacientes geriátricos
No es necesario el ajuste de dosis para pacientes geriátricos.
Pacientes pediátricos
La seguridad y eficacia de azilsartán medoxomilo/clortalidona en pacientes pediátricos no ha sido establecida.
Insuficiencia renal
No es necesario el ajuste de dosis para pacientes con insuficiencia renal leve (flujo de filtración glomerular estimado de 60-90 ml/min/1.73 m2) a moderada (flujo de filtración glomerular estimado 30-60 ml/min/1.73 m2). La seguridad y eficacia no han sido establecidas en pacientes con insuficiencia renal grave (flujo de filtración glomerular estimado <30 ml/min/1.73 m2).
Insuficiencia hepática
No es necesario el ajuste de dosis para pacientes con insuficiencia hepática leve a moderada. La seguridad y eficacia no han sido establecidas en pacientes con insuficiencia hepática grave.
Depleción salina y/o el volumen circulante disminuido
Corregir la depleción salina y/o el volumen circulante disminuido.


