SOLUCIÓN INYECTABLE
Estás aquí
Contáctanos
Solución inyectable
El frasco ámpula contiene:
Espesolimab 450 mg / 7.5 mL
Vehículo cbp
La jeringa prellenada contiene:
Espesolimab 150 mg / mL
Anticuerpo monoclonal humanizado de tipo inmunoglobulina G1 (IgG1) antagonista, que bloquea la señalización del IL-36R humano expresado en células de ovario de hámster chino (CHO)
Spevigo® está indicado para el tratamiento de la psoriasis pustulosa generalizada (PPG), lo que incluye el tratamiento y la prevención de brotes agudos en adultos y adolescentes desde los 12 años de edad.
Hipersensibilidad severa o potencialmente mortal a Spevigo® o a cualquiera de los excipientes (véase la sección Precauciones generales).
Resumen del perfil de seguridad
Se ha estudiado Spevigo en estudios clínicos que incluyeron 183 pacientes con PPG.
Los datos de seguridad presentados a continuación provienen de dos estudios aleatorizados, doble ciego, comparados con placebo que compararon el tratamiento con Spevigo respecto del placebo (Effisayil 1 y Effisayil 2, véase la sección Estudios clínicos) en pacientes con psoriasis pustulosa generalizada y siete estudios de Spevigo doble ciego, comparados con placebo para otras enfermedades.
En los estudios clínicos, las reacciones adversas más frecuentes informadas asociadas a Spevigo® fueron las infecciones.
Resumen tabulado de reacciones adversas
Categorías de frecuencia:
Muy frecuente ≥ 1/10
Frecuente ≥ 1/100 - < 1/10
Poco frecuente ≥ 1/1000 - < 1/100
Rara ≥ 1/10000 - < 1/1000
Muy rara < 1/10000
Frecuencia desconocida no se puede estimar a partir de los datos disponibles
Nota: Las categorías de frecuencia descriptas se basan en la Guía del Resumen de las Características del Producto (SmPC) de la Unión Europea (UE) (de septiembre de 2009); por ende, en países que no pertenecen a la UE es posible que sean apropiadas otras definiciones.
Resumen de reacciones adversas y las frecuencias correspondientes según la Guía del SmPC de la UE
|
Terminología de la Clasificación por órganos y sistemas (SOC) del MedDRA |
Reacciones adversas a Spevigo® |
Frecuencias conforme a la Guía del SmPC de la UE |
|
Infecciones e infestaciones |
Infección del tracto urinario
Infección del tracto respiratorio alto |
Frecuente
Muy frecuente |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito |
Frecuente |
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de inyección Fatiga |
Muy frecuente* Frecuente |
*No reportado en el estudio Effisayil-1.
Descripción de las reacciones adversas seleccionadas
Infecciones
Durante el período de 1 semana comparado con placebo en el estudio Effisayil-1, se informaron infecciones en el 17,1% de los pacientes tratados con Spevigo® en comparación con el 5,6% de los pacientes tratados con placebo. En Effisayil 1, se informó infección seria (infección del tracto urinario) en 1 paciente (2,9%) en el grupo Spevigo® y en ningún paciente en el grupo placebo. Durante el período comparado con placebo de hasta 48 semanas en Effisayil 2, se informaron infecciones en el 33.3% de los pacientes tratados con Spevigo® y en el 33.3% de los pacientes tratados con placebo. En Effisayil 2, se informaron infecciones serias en 3 pacientes (3.2%) en el grupo Spevigo® y en ningún paciente del grupo placebo.
Las infecciones observadas en los estudios clínicos con espesolimab fueron generalmente de intensidad entre leve y moderada sin un patrón distintivo en cuanto al agente patógeno o al tipo de infección.
Reacciones en el lugar de inyección
Las reacciones en la zona de inyección incluyen eritema, hinchazón, dolor, induración, calor, exfoliación, pápula, prurito, exantema y urticaria en el lugar de inyección. La gravedad de las reacciones en el lugar de inyección fue generalmente entre leve y moderada.
Población pediátrica
Los datos disponibles sobre adolescentes son limitados (véase la sección Estudios clínicos). No se han detectado nuevos problemas de seguridad en base a la cantidad limitada de pacientes adolescentes tratados.2
Caja con 2 jeringas prellenadas de 150 mg/mL
Caja con 2 frascos ámpula de vidrio de 450 mg/7.5 mL cada uno (60mg/mL).
El tratamiento con Spevigo® debe ser administrado y supervisado por médicos con experiencia en el manejo de pacientes con enfermedades inflamatorias de la piel.
El tratamiento con Spevigo® puede iniciarse con la jeringa prellenada Spevigo® como inyección subcutánea para prevenir los brotes agudos de PPG o con una dosis intravenosa de Spevigo® para tratar un brote agudo de PPG.
La solución inyectable en jeringa prellenada Spevigo® está prevista para uso subcutáneo en la prevención de brotes agudos de PPG solamente. El concentrado para solución para infusión Spevigo® está previsto para uso intravenoso en el tratamiento de brotes agudos de PPG solamente.
Dosis
Dosis recomendada para la prevención de brotes agudos de PPG
La dosis recomendada de Spevigo® para la prevención de brotes agudos de PPG en adultos y adolescentes desde los 12 años de edad es una dosis de carga subcutánea de 600 mg (cuatro inyecciones de 150 mg), seguida de 300 mg (dos inyecciones de 150 mg) administrados por vía subcutánea cada 4 semanas.
No se ha estudiado Spevigo® en pacientes con un peso corporal inferior a los 40 kg. No se pueden realizar recomendaciones de dosis (véase la sección Farmacocinética).
Tratamiento de brotes agudos de PPG durante el tratamiento preventivo subcutáneo de PPG
Si un paciente experimenta un brote agudo de PPG mientras recibe Spevigo® subcutáneo, el brote agudo de PPG puede tratarse con Spevigo® intravenoso (véase la sección Dosis recomendada para el tratamiento de brotes agudos de PPG).
Inicio o reinicio del tratamiento preventivo subcutáneo de PPG luego del tratamiento intravenoso de brotes agudos de PPG
Cuatro semanas luego del tratamiento intravenoso con Spevigo®, se puede iniciar o reiniciar Spevigo® subcutáneo con una dosis de 300 mg (dos inyecciones de 150 mg) administrada cada 4 semanas. No se requiere dosis de carga subcutánea.
Dosis recomendada para el tratamiento de brotes agudos de PPG
La dosis recomendada de Spevigo® solución para infusión para tratar un brote agudo de PPG es una dosis única de 900 mg (dos Frascos ámpula de 450 mg/7.5 mL) administradas como infusión intravenosa.
Si los síntomas de brote agudo persisten, puede administrarse otra dosis de 900 mg (dos frascos ámpula de 450 mg/7.5 ml) 1 semana después de la dosis inicial.
Dosis omitida
[Prevención de brotes agudos de PPG con solución inyectable en jeringa prellenada Spevigo®] Si se omite una dosis, esta debe administrarse lo antes posible. De allí en adelante, la administración debe reanudarse en el momento programado habitual.
Vía de administración
Solución inyectable en jeringa prellenada Spevigo®
La inyección debe administrarse por vía subcutánea en la parte superior de los muslos o en el abdomen (véase la sección Instrucciones de uso). La jeringa prellenada Spevigo® no debe inyectarse en áreas donde la piel esté sensible, con hematomas, eritematosa, indurada o con cicatrices.
De requerirse una dosis de carga subcutánea de 600 mg de Spevigo® (véase la sección Dosis y vía de administración), la dosis de carga debe ser administrada por un profesional sanitario. Se deberá elegir un lugar de inyección diferente para cada inyección, al menos a 2 cm de distancia de los otros lugares de inyección.
Para las dosis subcutáneas subsiguientes de 300 mg de Spevigo®, si el profesional sanitario lo determina correcto, los pacientes podrán autoadministrarse o sus cuidadores administrarles la jeringa prellenada Spevigo® luego de la correspondiente capacitación sobre la técnica de inyección subcutánea.
Para una dosis completa de 300 mg, se deben inyectar dos jeringas pre-llenadas de 150 mg/ml, una seguida inmediatamente de la otra. Se deberá elegir un lugar de inyección diferente para cada una de las dos inyecciones, al menos a 2 cm de distancia del otro lugar de inyección.
Solución para infusión Spevigo®
El concentrado para solución para infusión Spevigo® debe diluirse antes de usar (véase la sección Instrucciones de uso).
Spevigo® se administra como infusión intravenosa continua a través de una vía intravenosa que contiene un filtro estéril, apirogénico y de baja unión a proteínas (tamaño de poro de 0.2 micrones) durante 90 minutos.
En caso de que la infusión se reduzca o se interrumpa temporariamente, el tiempo total de infusión (incluido el tiempo de detención) no debe superar los 180 minutos (véase la sección precauciones generales).
Instrucciones de uso
Condiciones de almacenamiento
Solución inyectable en jeringa prellenada Spevigo
Antes de usar, la jeringa prellenada Spevigo puede conservarse a temperaturas de hasta 25 ºC durante un lapso de hasta 14 días si se mantiene en el envase original para resguardarla de la luz. La jeringa prellenada Spevigo debe descartarse si se ha conservado a temperaturas de hasta 25 ºC durante un lapso mayor a 14 días.
La jeringa prellenada Spevigo no debe usarse si se ha congelado, ni siquiera si se ha descongelado.
Solución para infusión Spevigo
Antes de usar, el frasco ámpula sin abrir puede conservarse a temperatura ambiente (hasta 30 ºC) durante un lapso de hasta 24 horas en el envase original para resguardarla de la luz.
Instrucciones de manejo y uso
Solución inyectable en jeringa pre-llenada Spevigo
Estas instrucciones de manejo y uso de la jeringa prellenada Spevigo contienen información sobre cómo inyectar Spevigo, si la dosis indicada a usted o a su hijo requiere de 2 jeringas prellenadas Spevigo.
Lea estas instrucciones de manejo y uso antes de usar Spevigo por primera vez y cada vez que obtenga reposición. Puede haber información nueva.
Esta información no reemplaza la consulta con su profesional sanitario sobre la enfermedad o sobre el tratamiento. Un profesional sanitario deberá enseñarle la forma correcta de inyectar Spevigo® antes de que usted intente autoinyectarse o inyectar a otra persona por primera vez.
Su médico le ha indicado una dosis de Spevigo® que requiere de dos inyecciones para obtener la dosis completa. Debe inyectar el contenido de dos jeringas prellenadas de Spevigo® provistas en el envase para obtener la dosis completa.
Spevigo® sirve para un único uso. NO reutilice la jeringa prellenada.
Conozca SPEVIGO®:
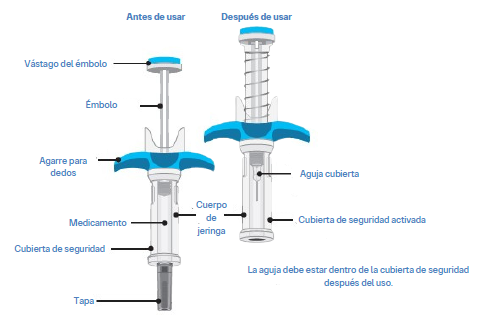
SPEVIGO® se presenta en una jeringa prellenada con una tapa de seguridad. La jeringa retrocede hacia adentro del protector de seguridad luego de la inyección.
Guía de piezas:
En la Figura 1 se muestra la jeringa prellenada Spevigo antes de su uso y luego de su uso con el protector de seguridad activado.
Figura 1
Información importante que debe conocer antes de inyectar SPEVIGO®
• Debe inyectar el contenido de ambas jeringas prellenadas Spevigo® para obtener una dosis completa.
• Revise el envase del producto para asegurarse de tener el medicamento correcto, la cantidad apropiada de jeringas prellenadas para la dosis indicada a usted o a su hijo, descartar daños y verificar la fecha de vencimiento.
• NO use Spevigo® si el líquido tiene aspecto turbio o contiene escamas o partículas grandes.
• NO use Spevigo® si la fecha de vencimiento (VTO) ya ha pasado.
• NO use Spevigo® si la jeringa prellenada se ha caído.
• NO remueva la tapa hasta que esté listo para inyectar.
• Inyecte Spevigo® debajo de la piel (inyección subcutánea) en la parte superior de los muslos o en el área del estómago (abdomen). NO inyecte Spevigo® en ninguna otra área del cuerpo.
• Mantenga Spevigo® y todo medicamento fuera del alcance de los niños.
|
Primerpaso |
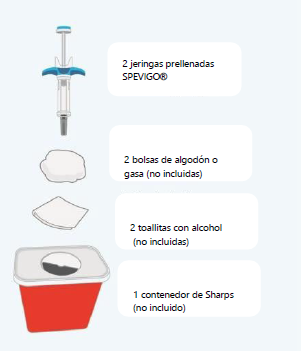
Reunir suministros |
|
|
• Saque el envase de SPEVIGO® del refrigerador y retire las jeringas prellenadas del envase. • Reúna los suministros enumerados anteriormente y colóquelos sobre una superficie de trabajo limpia y planaen una zona bien iluminada. • Si no dispone de todos los suministros mencionados, póngase en contacto con su farmacéutico. • Consulte el Paso 10: "Eliminación de las jeringas prellenadas y tapones SPEVIGO® usados". |
|
Paso 2 |
Preparación de la inyección de SPEVIGO® |
|
|
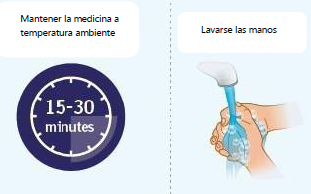
• Espere de 15 a 30 minutos para que el medicamento alcancela temperatura ambiente, a fin de evitar molestias durante la inyección. No acelere el proceso de calentamiento de ninguna manera, como utilizando el microondas o colocando la jeringaen agua caliente. • No deje las jeringas prellenadas a la luz directa del sol. • No retire la tapa de la aguja hasta que esté listo para inyectarse. • Lávate bien las manos con agua y jabón y sécatelas. |
|
Paso 3 |
Inspección de las jeringas prellenadas |
|
|
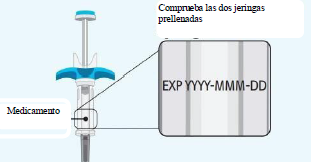
Comprueba que ambas jeringas estén prellenadas: • Compruebe que el nombre del medicamento SPEVIGO® y la dosis en sus jeringas prellenadas coinciden con la dosis prescrita a usted o a su hijo. • Compruebe la fecha de caducidad en ambas jeringas prellenadas. No las utilice si la fecha de caducidad ha pasado. • Compruebe que ambas jeringas prellenadas no estén dañadas, agrietadas o presenten fugas. No utilizar si alguna parte de las jeringas prellenadas aparece agrietada, rota o tiene fugas. |
Solución para infusión Spevigo®
El frasco ámpula debe someterse a inspección visual antes de usar. Spevigo® es una solución incolora a levemente amarillo parduzca, transparente a ligeramente opalescente. Si la solución presenta aspecto turbio, decoloración o partículas grandes o coloreadas, se debe descartar el frasco ámpula.
La solución para infusión debe prepararse con técnicas asépticas. Extraer y descartar 15 mL de un envase de 100 mL de solución estéril de cloruro de sodio al 0.9 % y reemplazar lentamente por 15 mL de Spevigo® (dos frascos ámpula de 450 mg/7.5 mL). Mezclar despacio antes de usar. La solución para infusión Spevigo® diluida debe usarse de inmediato.
Spevigo® no debe mezclarse con otros medicamentos. Spevigo® puede administrarse con una vía intravenosa preexistente. La vía debe lavarse con una solución estéril de cloruro de sodio al 0.9 % antes y después de la infusión. No debe administrarse otra infusión simultáneamente por el mismo acceso intravenoso.
Spevigo® es solo de uso único y no contiene conservadores.
La estabilidad físico-química durante el uso de la solución diluida se ha demostrado para un lapso de 24 horas entre 2 ºC y 30 ºC, seguido de un tiempo de infusión de 3 horas.
Desde la perspectiva microbiológica, la solución para infusión diluida debe usarse de inmediato. De no ser así, las condiciones de almacenamiento durante el uso son responsabilidad del usuario y, por lo general, no deberían exceder las 24 horas a 2-8 ºC, a menos que la dilución se haya realizado en condiciones de asepsia validadas y controladas. Durante el período transcurrido entre la preparación y el inicio de la administración, la solución para infusión debe conservarse a resguardo de la luz conforme a los procedimientos estándares locales.
No se han observado incompatibilidades entre Spevigo® y los conjuntos para infusión compuestos de policloruro de vinilo (PVC), polietileno (PE), polipropileno (PP), polibutadieno y poliuretano (PUR), y los filtros de membrana en la vía compuestos de polietersulfona (PES, neutra y con carga positiva) y poliamida (PA) con carga positiva.