XOLAIR
Estás aquí
Contáctanos

Forma Farmacéutica
Solución
Fórmula
Presentación en frasco ámpula
|
El frasco ámpula con polvo liofilizado contiene: |
|
|
Omalizumab |
202.5 mg |
|
Excipiente cbp |
|
|
La ampolleta con diluyente contiene: |
|
|
Agua estéril para uso inyectable |
2 mL |
|
Hecha la mezcla el frasco ámpula contiene: |
|
|
Omalizumab |
150 mg |
|
Vehículo cbp |
1.2 mL |
Presentación en jeringa prellenada y pluma precargada
|
La jeringa prellenada contiene: |
|||
|
Omalizumab |
75 mg |
150 mg |
300 mg |
|
Vehículo cbp |
0.5 mL |
1 mL |
2 mL |
|
La pluma precargada contiene: |
|||
|
Omalizumab |
75 mg |
150 mg |
300 mg |
|
Vehículo cbp |
0.5 mL |
1 mL |
2 mL |
|
Anticuerpo monoclonal humanizado de origen ADN recombinante expresado en células de ovario de hámster chino (CHO). |
|||
Asma Alérgica
XOLAIR® (Omalizumab) está indicado para el tratamiento de adultos y niños (de 6 años o mayores) afectados de asma alérgica moderada a grave, persistente cuyos síntomas no logran controlarse a pesar de dosis elevadas de corticosteroides inhalados.
XOLAIR® ha demostrado que disminuye la incidencia de exacerbaciones asmáticas en estos tipos de pacientes. La seguridad y la eficacia de XOLAIR® no se han establecido para otras condiciones alérgicas.
Rinosinusitis Crónica con Poliposis Nasal
XOLAIR® (Omalizumab) está indicado como tratamiento adyuvante a los corticosteroides intranasales para el tratamiento de adultos (mayores de 18 años) con rinosinusitis crónica con poliposis nasal severa, para los que el tratamiento con corticosteroides intranasales no proporciona un control adecuado de la enfermedad.
Urticaria Crónica Espontánea (UCE)
XOLAIR® (Omalizumab) está indicado para el tratamiento adyuvante de los adultos y adolescentes (mayores de 12 años) afectados de urticaria crónica espontanea resistente al tratamiento con antihistamínicos.
Hipersensibilidad al principio activo o a cualquiera de los excipientes, el embarazo y la lactancia.
Asma Alérgica
Resumen del Perfil de Seguridad
Las reacciones adversas medicamentosas más frecuentes en los estudios clínicos con adultos y con pacientes adolescentes de más de 12 años de edad fueron cefaleas y reacciones relacionadas con la inyección en el sitio e incluían dolor, hinchazón, eritema, y prurito. En estudios clínicos en pacientes de 6 a <12 años de edad las reacciones medicamentosas más comúnmente reportadas fueron dolor de cabeza, fiebre y dolor abdominal alto. La mayoría de los eventos fueron leves o moderados en severidad.
Resumen Estratificado de las Reacciones Adversas Medicamentosas de los Estudios Clínicos
La Tabla 1 resume las reacciones adversas medicamentosas registradas en los estudios clínicos en la población total con asma alérgica tratada con XOLAIR® del análisis de la seguridad, desglosadas por clase de órgano, aparato o sistema y por frecuencia. Según su frecuencia se clasifican en: Muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); infrecuentes (≥1/1,000 a <1/100); raras (≥1/10,000 a <1/1,000); muy raras (<1/10,000).
Tabla 1. Reacciones adversas medicamentosas registradas en los estudios clínicos para Asma Alérgica
|
Infecciones e infestaciones |
|
|
Infrecuente |
Faringitis |
|
Raro |
Parasitosis |
|
Trastornos del sistema inmunológico |
|
|
Raro |
Reacciones anafilácticas y otros trastornos alérgicos, producción de anticuerpos antiterapéuticos |
|
Trastornos del sistema nervioso |
|
|
Frecuente |
Cefalea** |
|
Infrecuente |
Mareos, somnolencia, parestesias, síncope |
|
Trastornos vasculares |
|
|
Infrecuente |
Hipotensión postural, crisis vasomotoras |
|
Trastornos respiratorios, torácicos y del mediastino |
|
|
Infrecuente |
Tos, broncoespasmo alérgico |
|
Raro |
Edema laríngeo |
|
Trastornos gastrointestinales |
|
|
Frecuente |
Dolor en la parte superior del abdomen* |
|
Infrecuente |
Náuseas, diarrea, signos y síntomas dispépticos |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Infrecuente |
Urticaria, exantema, prurito, fotosensibilidad |
|
Raro |
Angioedema |
|
Trastornos generales y en el lugar de la administración |
|
|
Muy frecuente |
Fiebre (pirexia)* |
|
Frecuente |
Reacciones en el lugar de la inyección, como dolor, eritema, prurito e hinchazón |
|
Infrecuente |
Aumento de peso, fatiga, brazos hinchados, síndrome seudogripal |
* En niños de 6 a < 12 años de edad
** Muy comunes en niños de 6 a < 12 años de edad
Las frecuencias de reacciones adversas medicamentosas en los pacientes del grupo que recibió el tratamiento activo fueron muy similares a las del grupo de control.
Rinosinusitis Crónica con Poliposis Nasal
Resumen del Perfil de Seguridad
Los datos que se describen a continuación provienen de dos estudios comparativos con placebo realizados en pacientes mayores de 18 años. En estos estudios, los pacientes recibieron placebo o XOLAIR® en dosis de entre 150 y 600 mg cada 2 o 4 semanas. Todos los pacientes recibieron un tratamiento de base con Mometasona intranasal. El perfil toxicológico observado en los pacientes con rinosinusitis crónica con poliposis nasal concordó con el observado en asma alérgica y UCE. Las reacciones adversas notificadas con mayor frecuencia (>3%), que fueron más frecuentes en comparación con el placebo, se muestran en la Tabla 2.
Resumen Tabulado de Reacciones Adversas Registradas en los Estudios Clínicos
La Tabla 2 presenta las reacciones adversas registradas durante los estudios clínicos en todos los pacientes con poliposis nasal tratados con XOLAIR® incluidos en la población de análisis de la seguridad, desglosadas por clase de órgano, aparato o sistema y por frecuencia. Según su frecuencia se clasifican en: Muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), infrecuentes (≥1/1000 a <1/100), raras (≥1/10 000 a <1/1000), y muy raras (<1/10 000).
Tabla 2. Reacciones adversas observadas en los estudios clínicos para Rinosinusitis Crónica con Poliposis Nasal.
|
Reacciones adversas medicamentosas (por término preferido del MedDRA) |
Estudios 1 y 2 para rinosinusitis crónica con poliposis nasal con Omalizumab, agrupados |
Categoría de frecuencia |
|
|
Placebo N = 130 |
Omalizumab N = 135 |
||
|
Trastornos del sistema nervioso |
|||
|
Cefalea |
7 (5.4%) |
11 (8.1%) |
Frecuente |
|
Mareo |
1 (0.8%) |
4 (3.0%) |
Frecuente |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||
|
Artralgia |
2 (1.5%) |
4 (3.0%) |
Frecuente |
|
Trastornos gastrointestinales |
|||
|
Dolor en la zona superior del abdomen |
1 (0.8%) |
4 (3.0%) |
Frecuente |
|
Trastornos generales y alteraciones en el lugar de administración |
|||
|
Reacciones en la zona de inyección (reacciones en la zona de inyección, reacción relacionada con la inyección, dolor en la zona de inyección) |
2 (1.5%) |
7 (5.2%) |
Frecuente |
Urticaria Crónica Espontánea (UCE)
Resumen del Perfil de Seguridad
La seguridad y la tolerabilidad de Omalizumab se evaluaron en 975 pacientes con UCE, de los cuales 733 recibieron Omalizumab durante 12 semanas en dosis de 75, 150 o 300 mg cada cuatro semanas y 242, el placebo. En 490 de los pacientes tratados con Omalizumab la administración duró 24 semanas. De los pacientes tratados con Omalizumab durante 12 semanas, 175 recibieron la dosis recomendada de 150 mg, y 412, la de 300 mg. De los pacientes tratados con Omalizumab durante 24 semanas, 87 recibieron la dosis recomendada de 150 mg, y 333, la de 300 mg.
Durante los estudios clínicos en adultos y adolescentes (mayores de 12 años de edad), las reacciones adversas medicamentosas más frecuentemente observadas fueron cefalea y nasofaringitis.
Resumen Tabulado de las Reacciones Adversas Medicamentosas Observadas en los Estudios Clínicos con las Dosis Recomendadas (150 o 300 mg)
La Tabla 3 presenta, ordenadas por clase de órgano, aparato o sistema del MedDRA, las reacciones adversas medicamentosas descritas con las dosis recomendadas (150 mg y 300 mg) en los tres estudios de fase III. Tales reacciones se observaron en ≥1% de los pacientes de cualquier grupo de tratamiento y con mayor frecuencia (≥2%) en los grupos que recibieron Omalizumab que, en los tratados con el placebo, según una evaluación médica. Dentro de cada clase de órgano, aparato o sistema las reacciones adversas medicamentosas figuran por orden decreciente de frecuencia. La categoría de frecuencia de cada reacción adversa se define según la siguiente convención (CIOMS III): Muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); infrecuentes (≥1/1,000 a <1/100); raras (≥1/10,000 a < 1/1,000); muy raras (<1/10,000).
Tabla 3. Reacciones adversas medicamentosas registradas en la base de datos conjuntos de seguridad en la UCE (desde el día 1 hasta la semana 12) con las dosis recomendadas.
|
Reacciones adversas medicamentosas (por término preferido del MedDRA) |
Estudios Q4881g, Q4882g y Q4883g en conjunto |
|
||
|
Placebo N=242 |
150 mg N=175 |
300 mg N=412 |
Categoría de frecuencia |
|
|
Infecciones e infestaciones |
||||
|
Nasofaringitis |
17 (7.0%) |
16 (9.1%) |
27 (6.6%) |
Frecuente |
|
Sinusitis |
5 (2.1%) |
2 (1.1%) |
20 (4.9%) |
Frecuente |
|
Infección viral de las vías respiratorias altas |
0 |
4 (2.3%) |
2 (0.5%) |
Frecuente |
|
Trastornos del sistema nervioso |
||||
|
Cefalea |
7 (2.9%) |
21 (12.0%) |
25 (6.1%) |
Muy frecuente |
|
Trastornos del aparato locomotor y del tejido conjuntivo |
||||
|
Artralgia |
1 (0.4%) |
5 (2.9%) |
12 (2.9%) |
Frecuente |
Acontecimientos descritos adicionalmente en cualquier momento del período de tratamiento entre el día 1 y la semana 24 (estudios Q4881g y Q4883g) que cumplían los criterios de reacciones adversas medicamentosas:
Infecciones e infestaciones: infección de las vías respiratorias altas (placebo: 3.1%, 150 mg: 3.4%, 300 mg: 5.7%), infección de las vías urinarias (placebo: 1.8%, 150 mg: 4.6%, 300 mg: 2.4%).
Trastornos del sistema nervioso: cefalea sinusal [por congestión de los senos paranasales] (placebo: 0%, 150 mg: 2.3%, 300 mg: 0.3%).
Trastornos del aparato locomotor y del tejido conjuntivo: mialgia (placebo: 0%, 150 mg: 2.3%, 300 mg: 0.9%), dolor en las extremidades (placebo: 0%, 150 mg: 3.4%, 300 mg: 0.9%), dolor osteomuscular (placebo: 0%, 150 mg: 2.3%,
300 mg: 0.9%).
Trastornos generales y en el lugar de la administración: pirexia (placebo: 1.2%, 150 mg: 3.4%, 300 mg: 0.9%).
Reacciones en el lugar de la inyección: Durante los estudios, las reacciones en el lugar de la inyección fueron más frecuentes en los pacientes del grupo de Omalizumab que en los del placebo (300 mg: 2.7%, 150 mg: 0.6%, placebo: 0.8%) y consistían en inflamación, eritema, dolor, equimosis, prurito, hemorragia y urticaria.
En un estudio de 48 semanas, 81 pacientes con UCE recibieron 300 mg de Omalizumab cada 4 semanas. El perfil de seguridad del uso a largo plazo fue similar al perfil de seguridad observado en estudios de UCE de hasta 24 semanas [82].
Reacciones Adversas Medicamentosas Mencionadas por Notificaciones Espontáneas desde la Comercialización del Producto (Frecuencia Desconocida)
Se han identificado las siguientes reacciones adversas medicamentosas a partir de la experiencia posterior a la comercialización con XOLAIR® mediante notificaciones espontáneas. Debido a que estas reacciones se informan de forma voluntaria en una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia que por lo tanto se clasifica como desconocida. Las reacciones adversas medicamentosas se enlistan de acuerdo con las clases del sistema de órganos en MedDRA. Dentro de cada clase de órganos del sistema, las reacciones adversas medicamentosas se presentan en orden decreciente de gravedad:
Trastornos del sistema inmunológico (ver PRECAUCIONES GENERALES): se han reportado anafilaxia y reacciones anafilactoides posteriormente a la primera o subsecuentes administraciones; enfermedad del suero.
Trastornos de la piel y tejidos subcutáneos: alopecia.
Trastornos de la sangre y tejido linfático: trombocitopenia idiopática severa.
Trastornos respiratorios, torácicos y del mediastino: Síndrome de Churg Strauss (es decir, granulomatosis eosinofílica con poliangiitis).
Trastornos músculo esqueléticos y del tejido conectivo: Artralgia, mialgia, inflamación articular.
Descripción de las Reacciones Adversas Medicamentosas más Importantes
Anafilaxia
En informes posteriores a la comercialización, la frecuencia de la anafilaxia en pacientes expuestos al uso de XOLAIR® se estimó en 0.2% con base a un número total de reacciones anafilácticas observadas desde una exposición estimada de más de 500,000 años paciente.
Trombocitopenia
En los estudios clínicos, pocos pacientes experimentaron recuentos de plaquetas por debajo del límite inferior del rango normal de laboratorio. Ninguno de estos cambios se asoció con episodios de sangrado o de una disminución en la hemoglobina. No se ha informado ningún patrón de disminución persistente en el recuento de plaquetas en humanos (pacientes mayores de 6 años), como se observó en primates no humanos (ver PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD). En la experiencia post-comercialización se han reportado casos de Trombocitopenia.
Infecciones Parasitarias
En pacientes afectados por asma alérgica con alto riesgo crónico de infección por helmintos, un estudio controlado con placebo mostró un ligero aumento numérico en la tasa de infección con Omalizumab que no fue estadísticamente significativo. El curso de la gravedad y la respuesta al tratamiento de infecciones no se modificaron (ver PRECAUCIONES GENERALES).
Descripción de los Eventos Adversos Seleccionados
Los siguientes eventos adversos se reportaron en pacientes tratados con XOLAIR®, sin embargo, no se ha establecido la frecuencia de los eventos adversos del uso de XOLAIR®.
Neoplasias Malignas
En los estudios clínicos iniciales realizadas en pacientes (mayores de 12 años de edad) se observó una diferencia numérica de casos de cáncer entre el grupo del tratamiento activo y el grupo de referencia. Los casos observados eran infrecuentes (<1/100) en ambos grupos de tratamiento activo y de referencia. En un estudio Fase IV de observación subsecuente donde se compararon 5,007 pacientes tratados con XOLAIR® y 2,829 que no fueron tratados con XOLAIR® a los cuales se les dio seguimiento durante un máximo de 5 años, las tasas de incidencia de tumores malignos primarios por cada 1,000 pacientes-año fueron 16.01 para el grupo con XOLAIR® (295/18,426 paciente-año) y 19.07 en grupo control (190/9,963 pacientes-año), respectivamente, lo que no indica un aumento de riesgo de malignidad (cociente de tasas de 0.84, intervalo de confianza del 95%, de 0.62 a 1.13). En un nuevo análisis de estudios clínicos aleatorizados, a doble ciego, controlados con placebo, los cuales incluyeron 4,254 pacientes tratados con XOLAIR® y 3,178 pacientes tratados con placebo, el tratamiento con XOLAIR® no se asoció con un riesgo mayor de malignidad basado en las tasas de incidencia por cada 1,000 pacientes-año de 4.14 (14/3,382 pacientes-año) para los pacientes tratados con XOLAIR® y 4.45 (11/2,474 pacientes-año) en los pacientes tratados con placebo (cociente de tasas 0.93, intervalo de confianza del 95%, de 0.39 a 2.27). El porcentaje de incidencia general de malignidad observado en el programa de estudios clínicos de XOLAIR® fue comparable al registrado en la población general.
No hubo casos de neoplasia maligna en los pacientes de entre 6 y <12 años de edad del grupo de Omalizumab de los estudios clínicos y se registró un solo caso de neoplasia maligna en el grupo de referencia.
Eventos Arteriales Tromboembólicos (EAT)
En estudios clínicos controlados y durante los análisis interinos de estudio observacional, se observó una diferencia numérica en EAT’s. Los EAT’s incluyeron EVC, ataque isquémico transitorio, infarto del miocardio, angina inestable y muerte de origen cardiovascular (incluyendo muerte de causa desconocida). En el análisis final del estudio observacional, la tasa de EAT por 1,000 pacientes-año fue de 7.52 (115/15,286 pacientes-año) para los pacientes tratados con XOLAIR® y 5.12 (51/9,963 pacientes-año) en los del grupo control. En un análisis de variables múltiples controlando por factores riesgo cardiovascular basales disponibles, el riesgo relativo fue de 1.32 (intervalo de confianza del 95%, de 0.91 a 1.91). En un análisis separado de estudios clínicos agrupados que incluyeron todos los estudios clínicos aleatorios, a doble ciego controlados con placebo de 8 o más semanas de duración, la tasa de ETA por 1,000 pacientes-año fue de 2.69 (5/1,856 pacientes-año) para los pacientes tratados con XOLAIR® y 2.38 (4/1,680 pacientes- año) en los pacientes tratados con placebo (cociente de tasas 1.13, intervalo de confianza del 95%, de 0.24 a 5.71).
Caja de cartón con un frasco ámpula con 150 mg de polvo liofilizado y una ampolleta con 2 mL de diluyente.
Caja de cartón con una jeringa prellenada con 75 mg/0.5 mL.
Caja de cartón con una jeringa prellenada con 150 mg/1 mL.
Caja de cartón con una jeringa prellenada con 300 mg/2 mL. Caja de cartón con una pluma precargada con 75 mg/0.5 mL.
Caja de cartón con una pluma precargada con 150 mg/1 mL.
Caja de cartón con una pluma precargada con 300 mg/2 mL.
Todas las presentaciones con instructivo anexo.
Régimen de Dosificación en Asma Alérgica y Rinosinusitis Crónica con Poliposis Nasal
La dosis para el asma y rinosinusitis crónica con poliposis nasal sigue los mismos principios de dosificación. La dosis apropiada (mg) y la frecuencia de administración de XOLAIR® para estas enfermedades se eligen de acuerdo a la concentración basal de la inmunoglobulina E (IgE) (UI/mL), medida antes de iniciar el tratamiento, y al peso corporal (kg). A efectos de la asignación de la dosis, antes de la administración inicial se debe valorar la concentración de IgE en los pacientes mediante una prueba comercial de IgE plasmática total. Basado en estas determinaciones, tal vez sea necesario administrar entre 75 y 600 mg de XOLAIR® por dosis, distribuido en 1 o 4 inyecciones (en diferente sitio de aplicación). Véase las Tabla 4 y la Tabla 5 como tablas de conversión y las Tablas 6 y 7 para la determinación de la dosis.
Los pacientes que están fuera de los niveles de IgE basales y del peso corporal indicado en la tabla de dosificación no deberían recibir XOLAIR®.
Tabla 4. Conversión de dosis a número de frascos ámpula, número de inyecciones y volumen total por cada administración
|
Dosis (mg) |
Número de frascos ámpula que deben reconstituirse |
Número de Inyecciones |
Volumen a administrar del frasco 1 ya reconstituido |
Volumen a administrar del frasco 2 ya reconstituido |
Volumen a administrar del frasco 3 ya reconstituido |
Volumen a administrar del frasco 4 ya reconstituido |
Volumen Total (mL) |
|
75 |
1 |
1 |
0.6 mL* |
|
|
|
0.6 |
|
150 |
1 |
1 |
1.2 mL |
|
|
|
1.2 |
|
225 |
2 |
2 |
0.6 mL* |
1.2 mL |
|
|
1.8 |
|
300 |
2 |
2 |
1.2 mL |
1.2 mL |
|
|
2.4 |
|
375 |
3 |
3 |
0.6 mL* |
1.2 mL |
1.2 mL |
|
3.0 |
|
450 |
3 |
3 |
1.2 mL |
1.2 mL |
1.2 mL |
|
3.6 |
|
525 |
4 |
4 |
0.6 mL* |
1.2 mL |
1.2 mL |
1.2 mL |
4.2 |
|
600 |
4 |
4 |
1.2 mL |
1.2 mL |
1.2 mL |
1.2 mL |
4.8 |
*El volumen máximo contenido por frasco ámpula es 1.2 mL, equivalente a XOLAIR® 150 mg, usar 0.6 mL de un frasco ámpula de 150 mg ya reconstituido. Desechar los 0.6 mL restantes.
Tabla 5. Conversión de la dosis en número de jeringas prellenadas/plumas precargadas*, número de inyecciones** y volumen total inyectado en cada administración
|
Dosis (mg) |
Número de jeringas prellenadas / plumas precargadas* |
Número de inyecciones |
Volumen total inyectado (mL) |
||
|
|
75 mg |
150 mg |
300 mg* |
|
|
|
75 |
1 |
0 |
0 |
1 |
0.5 |
|
150 |
0 |
1 |
0 |
1 |
1.0 |
|
225 |
1 |
1 |
0 |
2 |
1.5 |
|
300 |
0 |
0 |
1 |
1 |
2.0 |
|
375 |
1 |
0 |
1 |
2 |
2.5 |
|
450 |
0 |
1 |
1 |
2 |
3.0 |
|
525 |
1 |
1 |
1 |
3 |
3.5 |
|
600 |
0 |
0 |
2 |
2 |
4.0 |
*La jeringa prellenada de 300 mg de XOLAIR® y todas las presentaciones de XOLAIR® en pluma precargada no están destinadas para usarse en pacientes menores de 12 años.
**Esta tabla representa el número mínimo de inyecciones para los pacientes, sin embargo, hay otras combinaciones posibles de presentaciones de jeringas prellenadas/plumas precargadas para alcanzar la dosis deseada.
Duración del tratamiento, monitoreo y ajustes de dosis
En los estudios clínicos para asma alérgica se observó una reducción en las exacerbaciones asmáticas y en el uso de medicación de rescate, así como mejoría en la calificación de los síntomas durante las primeras 16 semanas de tratamiento. Son necesarias 12 semanas como mínimo para estimar adecuadamente si el paciente responde a XOLAIR®.
En los estudios clínicos para rinosinusitis crónica con poliposis nasal, se observaron cambios en la puntuación para poliposis nasal (NPS) y la puntuación de congestión nasal (NCS) en la primera evaluación a las 4 semanas. La necesidad de mantener el tratamiento se debe reevaluar periódicamente en función de la severidad de la enfermedad y el nivel de control de síntomas del paciente.
El uso de XOLAIR® está previsto para largo plazo. La interrupción del tratamiento generalmente resulta en un retorno de las concentraciones elevadas de IgE libre y de los síntomas asociados.
Los valores de IgE total son elevados durante el tratamiento y permanecen así hasta un año después de la interrupción del mismo. Por consiguiente, no se recomienda volver a medir las concentraciones de IgE durante el tratamiento con XOLAIR® para determinar la dosis. La determinación de la dosis tras interrupciones de tratamiento de menos de un año de duración debe basarse en las concentraciones plasmáticas de IgE obtenidas al principio. Si el tratamiento con XOLAIR® se ha interrumpido por más de un año, se pueden volver a medir las concentraciones plasmáticas de IgE total a efecto de determinar la dosis.
La dosis suele ajustarse por cambios significativos por el peso corporal (véase las Tablas 6 y 7).
Tabla 6. ADMINISTRACION CADA 4 SEMANAS – Asma Alérgica y Rinosinusitis Crónica con Poliposis Nasal. Dosis de XOLAIR® (miligramos por dosis) administrada por vía subcutánea cada 4 semanas
|
|
Peso (kg) |
|||||||||
|
IgE basal (UI/mL) |
≥20-25* |
>25-30* |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
|
³30-100 |
75 |
75 |
75 |
150 |
150 |
150 |
150 |
150 |
300 |
300 |
|
>100-200 |
150 |
150 |
150 |
300 |
300 |
300 |
300 |
300 |
450 |
600 |
|
>200-300 |
150 |
150 |
225 |
300 |
300 |
450 |
450 |
450 |
600 |
|
|
>300-400 |
225 |
225 |
300 |
450 |
450 |
450 |
600 |
600 |
|
|
|
>400-500 |
225 |
300 |
450 |
450 |
600 |
600 |
|
|
|
|
|
>500-600 |
300 |
300 |
450 |
600 |
600 |
ADMINISTRACIÓN CADA 2 SEMANAS: VÉASE LA TABLA 7. |
||||
|
>600-700 |
300 |
|
450 |
600 |
|
|||||
*En los estudios clínicos pivotales para rinosinusitis crónica con poliposis nasal no se incluyó a pacientes de menos de 30 kg de peso corporal.
Tabla 7. ADMINISTRACION CADA 2 SEMANAS – Asma Alérgica y Rinosinusitis Crónica con Poliposis Nasal. Dosis de XOLAIR® (miligramos por dosis) administrada por vía subcutánea, cada 2 semanas
|
Peso (kg) |
|||||||||||
|
IgE basal (UI/mL) |
≥20-25* |
>25-30* |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
>150- 200* |
|
≥ 30-100 |
|
225 |
|||||||||
|
> 100-200 |
375 |
||||||||||
|
> 200-300 |
ADMINISTRACIÓN CADA 4 SEMANAS: VÉASE LA TABLA 6. |
375 |
525 |
||||||||
|
> 300-400 |
|
450 |
525 |
|
|||||||
|
> 400-500 |
|
375 |
375 |
525 |
600 |
||||||
|
> 500-600 |
|
375 |
450 |
450 |
600 |
|
|||||
|
> 600-700 |
|
225 |
|
|
375 |
450 |
450 |
525 |
|
||
|
> 700-800 |
225 |
225 |
300 |
375 |
450 |
450 |
525 |
600 |
|
||
|
> 800-900 |
225 |
225 |
300 |
375 |
450 |
525 |
600 |
|
|||
|
> 900-1000 |
225 |
300 |
375 |
450 |
525 |
600 |
|
||||
|
> 1000-1100 |
225 |
300 |
375 |
450 |
600 |
No se dispone de información suficiente para recomendar una dosis. |
|||||
|
> 1100-1200 |
300 |
300 |
450 |
525 |
600 |
||||||
|
> 1200-1300 |
300 |
375 |
450 |
525 |
|
||||||
|
> 1300-1500 |
300 |
375 |
525 |
600 |
|
||||||
*En los estudios clínicos pivotales para rinosinusitis crónica con poliposis nasal no se incluyó a pacientes de menos de 30 kg de peso corporal y de más de 150 Kg.
Régimen de Dosificación en Urticaria Crónica Espontánea (UCE)
La dosis recomendada es de 300 mg administrada cada cuatro semanas por inyección subcutánea. Algunos pacientes pueden lograr un control de sus síntomas con una dosis de 150 mg administrada cada cuatro semanas.
Se recomienda que el médico evalúe periódicamente la necesidad de continuar el tratamiento.
Poblaciones Especiales
Insuficiencia Renal o Hepática
No existen estudios del efecto de la insuficiencia renal o hepática en la farmacocinética de Omalizumab. Como la depuración de Omalizumab, en dosis clínicas, depende principalmente del proceso de depuración de la IgG, por ejemplo, de su degradación en el sistema reticuloendotelial (RES), es improbable que una insuficiencia renal o hepática pueda alterarla. Mientras no se recomiende un ajuste particular en la dosis, XOLAIR® deberá ser administrado con precaución en estos pacientes (ver PRECAUCIONES GENERALES).
Pacientes Pediátricos
En el asma alérgica, no se ha determinado la inocuidad ni la eficacia del medicamento en pacientes menores de 6 años de edad; por consiguiente, no se recomienda el uso de XOLAIR® en tales pacientes.
En rinosinusitis crónica con poliposis nasal no se ha determinado la seguridad ni la eficacia del medicamento en pacientes menores de 18 años.
En la urticaria crónica espontánea, no se ha determinado la inocuidad ni la eficacia del medicamento en pacientes menores de 12 años de edad.
Pacientes Geriátricos (65 años o más)
Existen datos escasos del uso de XOLAIR® en pacientes mayores de 65 años, pero no existe evidencia de que estos pacientes requieran de una dosis diferente que la utilizada en adultos menores de 65 años.
Método de Administración
Presentación en frasco ámpula con polvo liofilizado y diluyente para la solución inyectable
Únicamente para administración vía subcutánea. XOLAIR® no debe administrarse por vía intravenosa o intramuscular. Las dosis de más de 150 mg deben dividirse en dos o más sitios de inyección.
La experiencia con la autoadministración de XOLAIR® en frasco ámpula con polvo liofilizado y diluyente para la solución para inyección es limitada. Por lo que, el tratamiento con esta formulación está destinado a ser administrado únicamente por un profesional de la salud.
Las instrucciones completas de uso se proporcionarán más adelante.
Presentación en jeringa prellenada / pluma precargada
Únicamente para administración vía subcutánea. XOLAIR® no debe administrarse por vía intravenosa o intramuscular.
La jeringa prellenada de 300 mg de XOLAIR® y todas las presentaciones de XOLAIR® en pluma precargada no están destinadas para usarse en pacientes menores de 12 años. Las jeringas prellenadas de 75 mg y de 150 mg de XOLAIR® o la presentación en frasco ámpula con polvo liofilizado de XOLAIR® pueden usarse en niños de 6 a 11 años con asma alérgica.
Si se necesita más de una inyección para alcanzar la dosis requerida, las inyecciones deben dividirse en dos o más sitios de inyección (Ver Tabla 5).
Los pacientes sin antecedentes de anafilaxia pueden autoinyectarse XOLAIR® o ser inyectados por un cuidador, a partir de la cuarta dosis en adelante si el médico determina que es apropiado. (Ver PRECAUCIONES GENERALES). El paciente o cuidador deben haber recibido capacitación de la técnica de administración correcta, así como en el reconocimiento de los signos y síntomas tempranos de las reacciones alérgicas graves.
Se debe instruir a los pacientes o profesionales de salud que inyecten la cantidad completa de XOLAIR® de acuerdo con las instrucciones de uso.
Instrucciones de Uso
- Instrucciones de uso y manipulación de XOLAIR® en frasco ámpula con polvo liofilizado y diluyente para solución inyectable.
La siguiente información está dirigida únicamente a profesionales de la salud o médicos.
XOLAIR® se suministra en frasco ámpula para uso único y no contiene conservadores antibacterianos. Se ha demostrado la estabilidad química y física del producto reconstituido durante 8 horas entre 2°C y 8°C y durante 4 horas a 30°C. Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente después de la reconstitución. Si no se usara de inmediato, el tiempo de conservación durante el uso y las condiciones de conservación antes del uso son responsabilidad del usuario; dicho periodo normalmente no debería ser mayor de 8 horas a temperaturas de 2°C a 8°C o 2 horas a 25°C. Si el producto no ha sido administrado y excedió este periodo deberá desecharse.
El producto liofilizado necesita de 15 a 20 minutos para disolverse, pero en algunos casos puede requerir más tiempo. El producto completamente reconstituido tiene un aspecto claro a ligeramente opalescente, de incoloro a un tono café amarillento y puede presentar burbujas pequeñas o espuma en la superficie. Dado que el producto reconstituido es algo viscoso, se debe tener precaución para EXTRAER TODO EL PRODUCTO DEL FRASCO ÁMPULA antes de eliminar el aire o el exceso de solución de la jeringa, para obtener la dosis completa de 1.2 mL.
Para preparar XOLAIR® para la administración subcutánea, sírvase seguir las siguientes indicaciones:
- Con una jeringa equipada de una aguja gruesa de calibre 18, extraiga 1.4 mL de agua inyectable de la ampolleta.
- Con el frasco ámpula en posición vertical sobre una superficie plana, inserte la aguja y vierta el agua inyectable dentro del frasco ámpula de Omalizumab, utilizando técnicas asépticas convencionales, dirigiendo el agua directamente sobre el polvo liofilizado.
- Con el frasco ámpula siempre en posición vertical, mezclar en círculos con vigor (¡sin agitar!) por espacio de un minuto hasta que el polvo se humedezca de manera uniforme.
- Para acelerar la disolución después de completar el paso 3, agite en círculos el frasco ámpula boca arriba, esta vez de forma suave, por espacio de 5 o 10 segundos cada 5 minutos a fin de disolver el polvo restante. Tome en cuenta que en ocasiones quizás necesite más de 20 minutos para disolver el polvo por completo. En tal caso, repita el paso 4 hasta que desaparezcan las partículas gelatinosas de la solución. Una vez que el polvo se haya disuelto por completo, no deben quedar partículas gelatinosas en la solución. Las burbujas pequeñas o la espuma en la superficie del líquido son perfectamente normales. El producto reconstituido tiene un aspecto claro o ligeramente opaco. No utilice el producto si observa partículas extrañas.
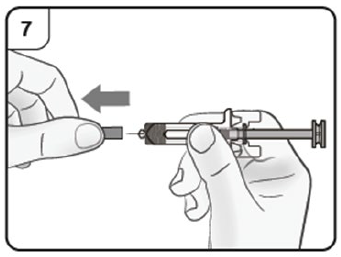
- Coloque el frasco ámpula boca abajo durante 15 segundos para que la solución fluya hacia el tapón. Utilice una nueva jeringa de 3 centímetros cúbicos equipada de una aguja gruesa de calibre 18 e inserte la aguja en el frasco ámpula invertido. Coloque el extremo de la aguja justo al final de la solución. Antes de extraer la aguja del frasco ámpula, tire del émbolo y llévelo hasta el final de la jeringa para extraer toda la solución del frasco ámpula invertido.
- Reemplace la aguja de calibre 18 por una de calibre 25 para inyección subcutánea.
- Elimine el aire, las burbujas grandes y cualquier exceso de solución a fin de obtener la dosis requerida de 1.2 mL de XOLAIR®. Puede quedar una fina capa de pequeñas burbujas flotando en la superficie de la solución contenida en la jeringa. Como la solución es algo viscosa, la administración de la inyección puede durar entre 5 y 10 segundos. El frasco ámpula entrega 1.2 mL (150 mg) de XOLAIR®.
- La administración de XOLAIR® es subcutánea en el brazo, muslo o en la parte inferior del abdomen (pero no en el área de 5 cm alrededor del ombligo). No inyecte en áreas donde la piel esté sensible, lastimada, roja o dura. Evite las áreas con cicatrices o estrías. Si necesita administrar más de una inyección para la dosis completa, elija un lugar de inyección diferente cada vez que se inyecte.
Cualquier producto no utilizado o material de desecho debe eliminarse adecuadamente.
- Instrucciones de uso y manipulación de XOLAIR® en jeringa prellenada (jeringa prellenada con aguja calibre 26G ½”)
Lea todas las instrucciones antes de usar la jeringa. Si decide que el paciente o un profesional de la salud pueden administrar las inyecciones de XOLAIR® en el hogar, deben ser previamente capacitados por el médico o enfermero antes de inyectarse a sí mismo u a otros. No se espera que los niños (de 6 años a menores de 12 años) se inyecten a sí mismos XOLAIR®, sin embargo, si lo considera mejor un cuidador puede administrarles XOLAIR® después de recibir la capacitación adecuada. Cada caja de XOLAIR® contiene una jeringa prellenada, acondicionada individualmente en un envoltorio de plástico sellado.
La jeringa prellenada de XOLAIR® está disponible en dos concentraciones 75 mg y 150 mg. Se puede adquirir una o ambas en la farmacia.
Jeringa prellenada de XOLAIR® 75 mg
Jeringa prellenada XOLAIR® 150 mg
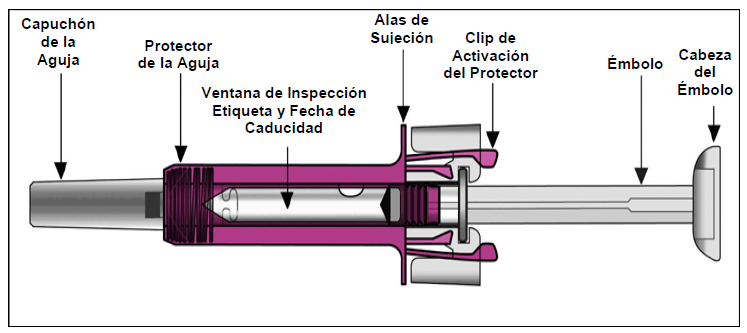
Después de inyectar el medicamento, el protector se activará para cubrir la aguja. Esto tiene la finalidad de proteger contra lesiones accidentales por pinchazos con la aguja.
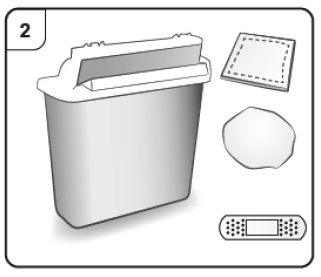
Otros artículos que necesita para la inyección:
|
|
|
|
|
Información importante relativa a la seguridad
Advertencia: Mantenga la jeringa fuera del alcance de los niños
- El capuchón de la aguja de la jeringa puede contener goma seca (látex), que no debe ser manipulada por personas que sean sensibles a ella.
- No abra la caja hasta estar listo para usar este medicamento.
- No utilice la jeringa si el sello de la caja o la charola de plástico están rotos, ya que esto puede implicar un riesgo para usted.
- No utilice si la jeringa ha caído sobre una superficie dura o se ha caído tras retirar el capuchón de la aguja.
- Nunca deje la jeringa donde otras personas puedan manipularla.
- No agite la jeringa.
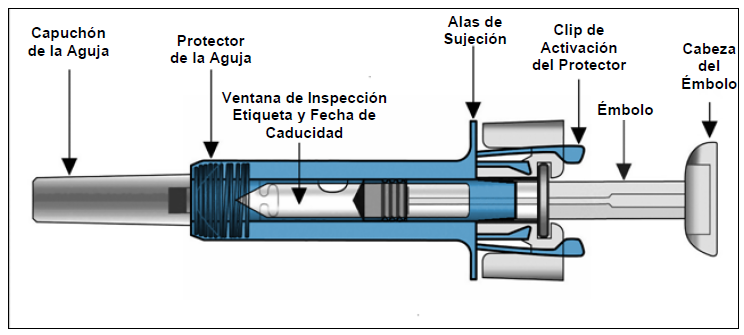
- Tenga cuidado de no tocar los clips de activación del protector antes de usar la jeringa (véase las ilustraciones anteriores). Al tocarlos, el protector puede activarse demasiado pronto.
- No retire el capuchón de la aguja hasta que esté usted listo para poner la inyección.
- La jeringa no puede reutilizarse. Deseche la jeringa inmediatamente después de usarla en el contenedor de deshecho de objetos punzocortantes.
Conservación de la jeringa prellenada
- Conserve la jeringa sellada dentro de su caja para protegerla de la luz, en refrigeración, entre 2°C y 8 °C. NO SE CONGELE.
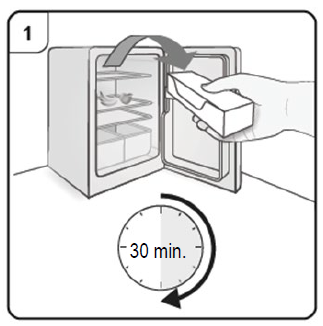
- Saque la jeringa del refrigerador y deje que alcance la temperatura ambiente (25°C) antes de prepararla para la inyección (aproximadamente 30 minutos). Deje la jeringa en la caja para protegerla de la luz. Si es necesario, el producto puede devolverse al refrigerador para su uso posterior. El tiempo total que la jeringa se mantiene a temperatura ambiente a no más de 25°C antes de usarla no debe exceder las 48 horas.
- No utilice la jeringa después de la fecha de caducidad indicada en la caja o en la etiqueta de la jeringa. Si ha caducado, devuelva todo el producto a la farmacia.
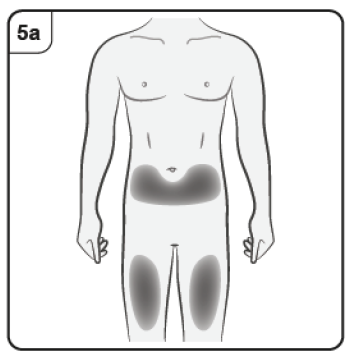
Lugar de inyección
|
|
El lugar de inyección es el sitio del cuerpo donde usted pondrá la inyección.
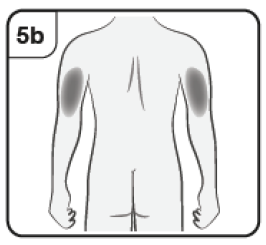
Si un cuidador está administrando la inyección, también se puede inyectar en los brazos superiores externos.
|
Preparación de la Jeringa Prellenada de XOLAIR® para su Uso
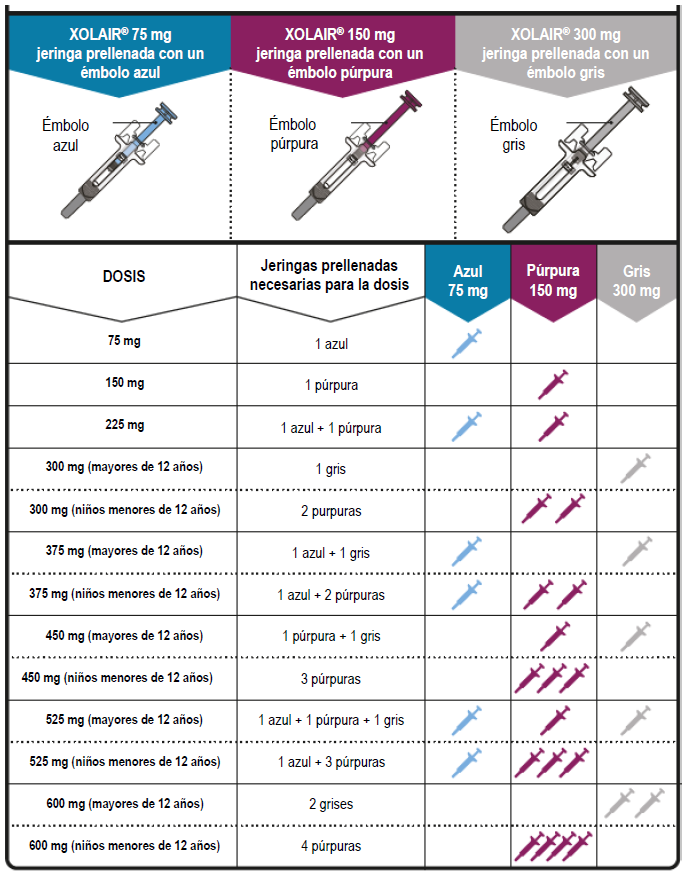
NOTA: Dependiendo de la dosis prescrita, es posible que deba preparar una o más jeringas prellenadas e inyectar el contenido de todas ellas. La Tabla 8 proporciona ejemplos del número de jeringas prellenadas que se necesitan para una dosis determinada.
Tabla 8. Conversión de la dosis en número de jeringas prellenadas.

- Saque la caja que contiene la jeringa del refrigerador y déjela unos 30 minutos sin abrir para que alcance la temperatura ambiente (deje la jeringa dentro de la caja para protegerla de la luz).
- Cuando esté listo para utilizar la jeringa, lávese bien las manos con agua y jabón.
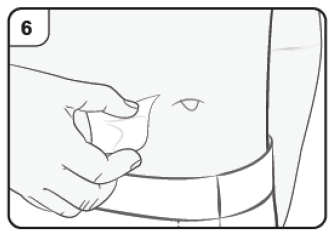
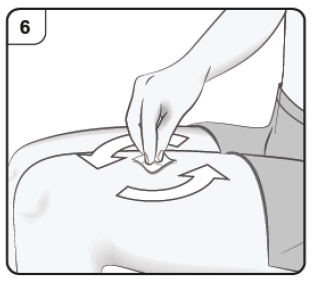
- Limpie el lugar del cuerpo donde pondrá la inyección con una torunda de alcohol.
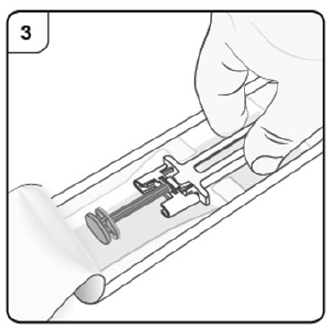
- Retire la charola de plástico de la caja, desprenda la cubierta de papel. Sujetando el centro del protector de la jeringa, extraiga la jeringa de la charola.
- Examine la jeringa. El líquido debe ser claro o ligeramente turbio. Su color puede variar de incoloro a amarillo pálido. Es posible que se perciban burbujas de aire, lo cual es normal. NO USE la jeringa si está rota o si el líquido parece turbio, si presenta claramente un color marrón o si contiene partículas. En todos estos casos devuelva el paquete completo a la farmacia.
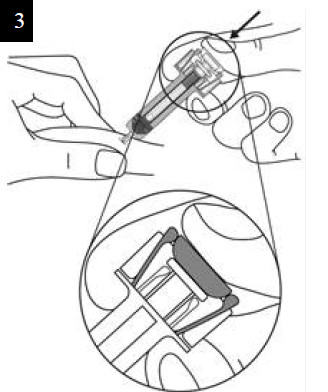
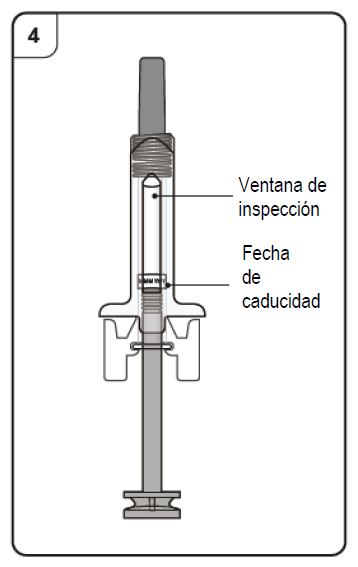
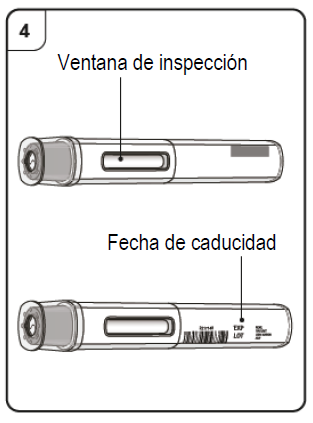
- Sosteniendo la jeringa horizontalmente, verifique en la ventana de inspección la fecha de caducidad impresa en la etiqueta.
Nota: Gire la parte interna de la jeringa, de modo que pueda leer la etiqueta a través de la ventana de inspección. NO USE el producto si está caduco. Si ha caducado, devuelva el producto con su envase a la farmacia.
Cómo usar la jeringa prellenada
|
|
Cuidadosamente retire el capuchón de la aguja. Es posible que vea una gota de líquido en el extremo de la aguja. Esto es normal. |
|
|
Presione suavemente la piel del lugar de inyección e inserte la aguja como se muestra en la imagen. Empuje la aguja hasta el fondo para asegurarse de que el medicamento se pueda administrar completamente. |
|
|
Sostenga la jeringa como se muestra en la imagen. Presione lentamente el émbolo hacia abajo hasta haber inyectado toda la solución. |
|
|
Mantenga el émbolo completamente presionado mientras levanta con cuidado la aguja del lugar de inyección. |
|
|
Suelte el émbolo lentamente y deje que el protector cubra automáticamente la aguja expuesta. Puede presionar el lugar de inyección con una torunda de algodón o una gasa y mantenerla durante 30 segundos. No frote el lugar de la inyección. Puede cubrir el lugar de la inyección con una pequeña venda adhesiva, si es necesario. |
Instrucciones de eliminación
|
|
Deseche de inmediato la jeringa usada en un recipiente para objetos punzocortantes. Para la seguridad y salud de usted y los demás, las agujas y las jeringas usadas NUNCA deben reutilizarse. Cualquier medicamento no utilizado o material de desecho debe eliminarse de acuerdo con los requisitos locales. No tire los medicamentos a través de aguas residuales o de residuos domésticos. Pregunte a su médico cómo deshacerse de los medicamentos que ya no usa. Estas medidas ayudarán a proteger el medio ambiente.
|
Instrucciones de uso y manipulación de XOLAIR® en jeringa prellenada (jeringa prellenada con aguja calibre 27G½”) [79]
Estas “Instrucciones de uso” contienen la información sobre cómo inyectar XOLAIR®
Si su médico decide que usted o su cuidador pueden administrar las inyecciones de XOLAIR® en casa, asegúrese de que su médico o enfermera le muestren a usted o a su cuidador cómo preparar e inyectar la jeringa prellenada de XOLAIR® antes de usarla para la primera vez.
No se espera que los niños menores de 12 años se inyecten XOLAIR® ellos mismos, sin embargo, si su médico lo considera apropiado, un cuidador puede administrarles las inyecciones de XOLAIR® después de una capacitación adecuada.
Asegúrese de leer y comprender estas “Instrucciones de uso” antes de inyectar la jeringa prellenada de XOLAIR®
Hable con su médico si tiene alguna pregunta.
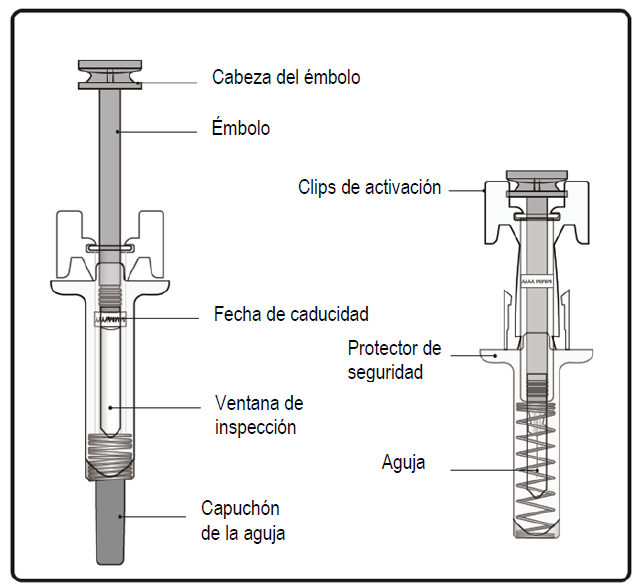
Información importante que debe conocer antes de inyectar XOLAIR®
- XOLAIR® debe inyectarse únicamente por vía subcutánea (inyecte directamente en la capa de grasa situada debajo de la piel).
- No utilice la jeringa prellenada si el sello de la caja o la charola de plástico están rotos.
- No utilice si la jeringa prellenada ha caído sobre una superficie dura o se ha caído tras retirar el capuchón de la aguja.
- No lo inyecte si la jeringa prellenada se ha dejado sin refrigerar durante más de 48 horas. Deséchela (ver paso 12) y utilice una nueva jeringa prellenada para su inyección.
- La jeringa prellenada tiene un protector de seguridad que se activará para cubrir la aguja después de que finalice la inyección. El protector de seguridad ayudará a evitar que cualquier persona que manipule la jeringa prellenada después de la inyección sufra lesiones por pinchazos con la aguja.
- No intente reutilizar ni desmontar la jeringa prellenada.
- No tire del émbolo hacia atrás.
Conservación de XOLAIR®
- Conservar en refrigeración (a una temperatura de entre 2°C y 8°C). La caja que contiene la jeringa prellenada puede conservarse durante un total de 48 horas a temperatura ambiente (25°C) antes de su uso. Si es necesario, puede volver a refrigerarse.
- No la congele.
- Conserve la jeringa prellenada en el envase original para protegerla de la luz hasta el momento de usarla.
- Mantenga la jeringa prellenada fuera de la vista y del alcance de los niños.
Tabla de Dosificación
Las jeringas prellenadas de XOLAIR® están disponibles en 3 presentaciones/concentraciones (una jeringa prellenada en cada caja). Estas instrucciones son las mismas para las 3 presentaciones/concentraciones.
Dependiendo de la dosis que le haya recetado su médico, es posible que deba seleccionar una o más jeringas prellenadas e inyectar el contenido de todas ellas para administrar la dosis completa. La siguiente tabla de dosificación muestra la combinación de jeringas prellenadas necesarias para administrar su dosis completa.
|
|
Importante: Si la dosis es para un niño menor de 12 años, se recomienda utilizar únicamente jeringas prellenadas de color azul (75 mg) y púrpura (150 mg). Consulte la Tabla de Dosificación para conocer la combinación recomendada de jeringas prellenadas para niños menores de 12 años. |
Si tiene alguna duda sobre la Tabla de Dosificación, póngase en contacto con su médico.
Preparación para la inyección de XOLAIR®
|
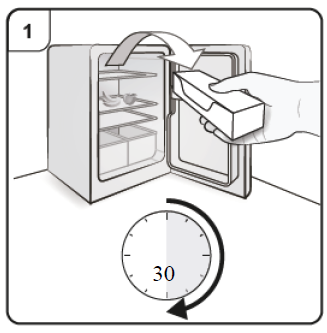
Paso 1. Lleve a temperatura ambiente Saque del refrigerador la caja que contiene la jeringa prellenada y déjela reposar sin abrirla para que alcance la temperatura ambiente (mínimo 30 minutos). Nota: Si necesita más de una jeringa prellenada (una jeringa prellenada por caja) para administrar su dosis completa (ver Tabla de Dosificación), saque del refrigerador todas las cajas al mismo tiempo. |
|
|
Paso 2. Reúna el material necesario Necesitará el siguiente material (no incluido en la caja): · Toallita empapada en alcohol · Gasa o torunda de algodón · Recipiente para objetos punzantes Banda adhesiva |
|
|
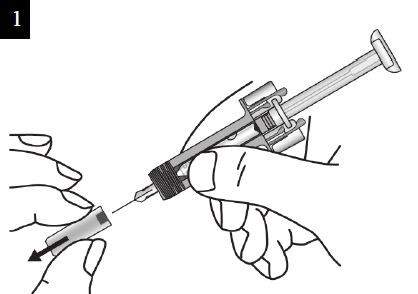
Paso 3. Desempaque Abra la charola de plástico quitando la cubierta. Retire la jeringa prellenada sujetándola por la mitad como se muestra. No retire el capuchón de la aguja hasta que esté listo para aplicar la inyección. |
|
|
Paso 4. Inspeccione la jeringa prellenada Mire a través de la ventana de inspección de la jeringa prellenada. El líquido del interior debe ser transparente o ligeramente turbio, y puede ser incoloro a levemente amarillo-parduzco. Es posible que vea burbujas de aire, pero eso es normal. No intente quitar el aire. · No utilice la jeringa prellenada si el líquido contiene partículas o si el líquido se ve claramente turbio o claramente marrón. · No utilice la jeringa prellenada si parece dañada o si tiene fugas. · No utilice la jeringa prellenada después de la fecha de caducidad, que está impresa en la etiqueta de la jeringa prellenada y en la caja. Ante cualquiera de estos casos, póngase en contacto con su médico. |
|
|
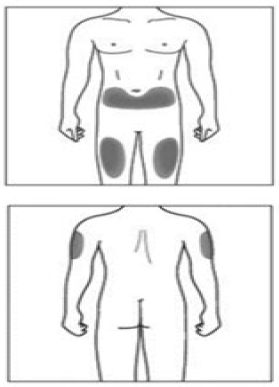
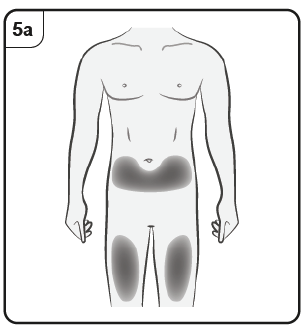
Paso 5. Elija el lugar de la inyección Debe aplicar la inyección en la parte delantera de los muslos o en la zona inferior del abdomen, pero no a menos de 5 cm del ombligo. No aplique la inyección en zonas de piel sensibles, contusionadas, enrojecidas, escamosas o duras, ni en zonas con cicatrices o estrías. Nota: Si necesita más de una jeringa prellenada para administrar su dosis completa, asegúrese de que las inyecciones estén separadas al menos 2 cm. |
|
|
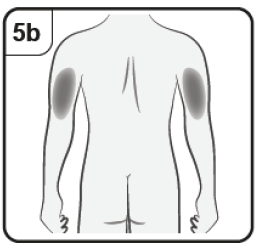
Si el cuidador, el médico o el enfermero aplica la inyección, también puede ponerse en la parte superior externa del brazo. |
|
Inyección con XOLAIR®
|
Paso 6. Limpie el lugar de la inyección Lávese las manos. Desinfecte el lugar de la inyección con una toallita empapada en alcohol. Deje secar la zona antes de aplicar la inyección. No toque ni sople la piel limpia antes de la inyección. |
|
|
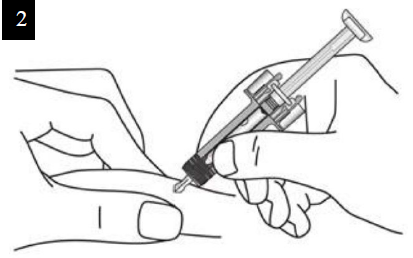
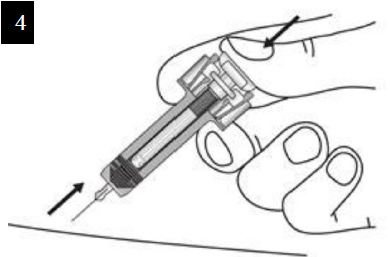
Paso 7. Retire la tapa de la aguja Tire firmemente sin doblar la aguja para retirar el capuchón de la jeringa prellenada. Puede que observe una gota de producto en la punta de la aguja. Esto es normal. No vuelva a colocar el capuchón de la aguja. Deseche el capuchón de la aguja. |
|
|
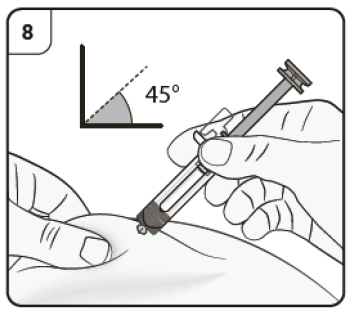
Paso 8. Inserte la aguja Pellizque suavemente la piel en el lugar de la inyección y no la suelte mientras dure la inyección. Con la otra mano introduzca la aguja en la piel con un ángulo de aproximadamente 45 grados como se muestra. No presione el émbolo mientras introduce la aguja. |
|
|
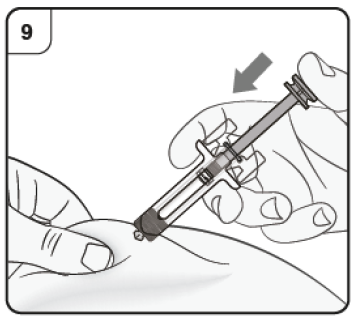
Paso 9. Inicie la inyección Continúe pellizcando la piel. Presione lentamente el émbolo hasta el fondo. De esta forma asegura la inyección de la dosis completa. |
|
|
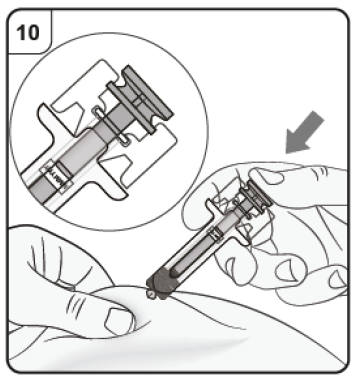
Paso 10. Complete la inyección Confirme que la cabeza del émbolo se encuentra entre los clips de activación del protector de seguridad, tal y como se muestra. De esta forma se asegura que el protector de seguridad se haya activado y cubrirá la aguja una vez finalizada la inyección. |
|
|
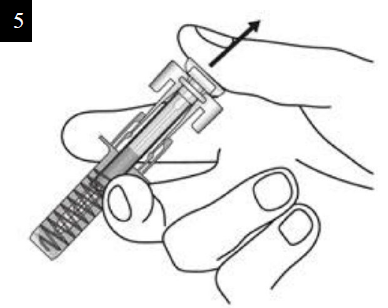
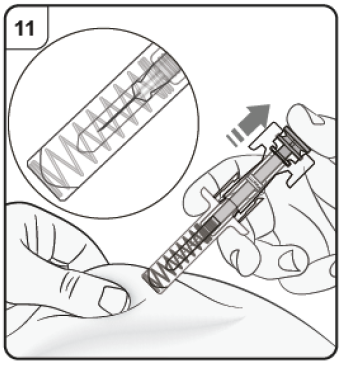
Paso 11. Suelte el émbolo Manteniendo la jeringa prellenada en el lugar de inyección, suelte lentamente el émbolo hasta que la aguja quede cubierta por el protector de seguridad. Retire la jeringa prellenada del lugar de la inyección y deje de pellizcar la piel. Es posible que haya un poco de sangre en el lugar de la inyección. Puede presionar con una gasa o torunda de algodón el lugar de la inyección hasta que el sangrado se detenga. No frote el lugar de la inyección. Si es necesario, cubra el lugar de la inyección con una pequeña venda adhesiva. Nota: Si necesita más de una jeringa prellenada para administrar su dosis completa, deseche la jeringa prellenada usada tal y como se describe en el paso 12. Repita el paso 2 al paso 12 con todas las jeringas prellenadas necesarias para administrar la dosis completa. Aplique las inyecciones inmediatamente una después de otra. Asegúrese de que la separación entre inyecciones sea de al menos 2 cm. |
|
Después de la inyección
|
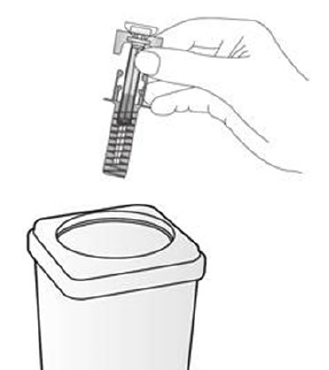
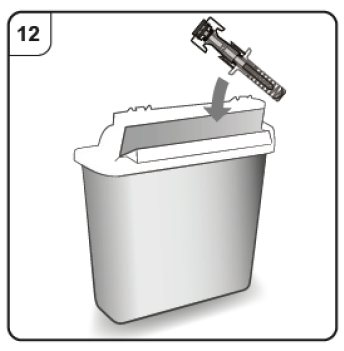
Paso 12. Deseche la jeringa prellenada Deposite la jeringa prellenada usada en un recipiente para objetos punzantes (es decir, en un recipiente resistente a la punción y con tapa, u otro similar) inmediatamente después de su uso. No tire la jeringa prellenada a la basura doméstica. No intente volver a colocar el capuchón de la aguja en la jeringa. Pregunte a su médico cómo desechar correctamente el recipiente para objetos punzantes. Es posible que exista una regulación local al respecto.
|
|
- Instrucciones de uso y manipulación de XOLAIR® en pluma precargada [79]
Estas “Instrucciones de uso” contienen información sobre cómo inyectar XOLAIR®
Si su médico decide que usted o su cuidador pueden administrar las inyecciones de XOLAIR® en casa, asegúrese de que su médico o enfermero le enseñe a usted o a su cuidador cómo preparar e inyectar la pluma de XOLAIR® antes de utilizarla por primera vez.
La pluma de XOLAIR® está indicada para pacientes mayores de 12 años.
Asegúrese de leer y comprender estas “Instrucciones de uso” antes de inyectar la pluma de XOLAIR®. Si tiene alguna duda, consulte a su médico.
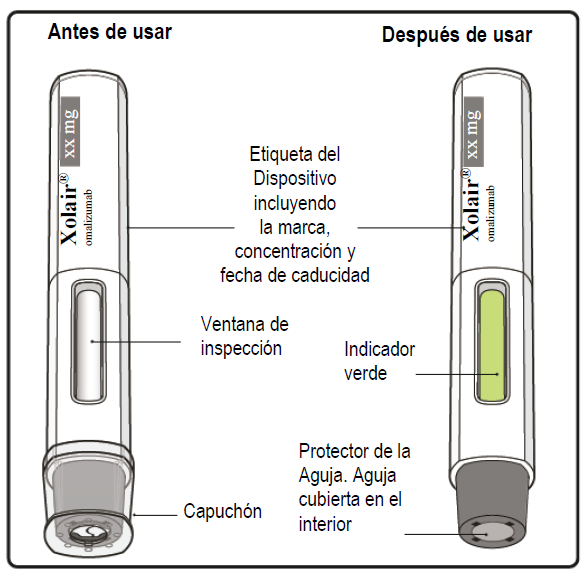
Información importante que debe conocer antes de inyectar XOLAIR®
- XOLAIR® debe inyectarse únicamente por vía subcutánea (inyecte directamente en la capa grasa situada debajo de la piel).
- No utilice la pluma si el sello de la caja está roto.
- No use la pluma si se ha caído después de quitar el capuchón.
- No lo inyecte si la pluma se ha dejado sin refrigerar durante más de 48 horas en total. Deséchela (ver paso 13) y utilice una nueva pluma para su inyección.
- No toque ni presione el protector de la aguja, ya que podría lesionarse. Tocar o presionar el protector de la aguja podría causar una lesión por pinchazo.
- No intente reutilizar ni desmontar la pluma.
- No intente volver a colocar el capuchón una vez que se ha retirado.
Conservación de XOLAIR®
- Conservar en refrigeración (a una temperatura de entre 2°C y 8°C). La caja que contiene la pluma puede conservarse durante un total de 48 horas a temperatura ambiente (25 °C) antes de su uso. Si es necesario, puede volver a refrigerarse.
- No la congele.
- Conserve la pluma en el envase original para protegerla de la luz hasta el momento de usarla.
- Mantenga la pluma fuera de la vista y del alcance de los niños.
Tabla de Dosificación
Las plumas precargadas de XOLAIR® están disponibles en 3 presentaciones/concentraciones (una pluma en cada caja). Estas instrucciones son las mismas para las tres presentaciones/concentraciones.
En función de la dosis que le haya recetado el médico, es posible que usted tenga que seleccionar más de una pluma precargada e inyectar el contenido de todas ellas para alcanzar la dosis completa. La siguiente tabla de dosificación muestra la combinación de plumas precargadas necesarias para administrar su dosis completa.
Si tiene alguna duda sobre la Tabla de Dosificación, póngase en contacto con su médico.
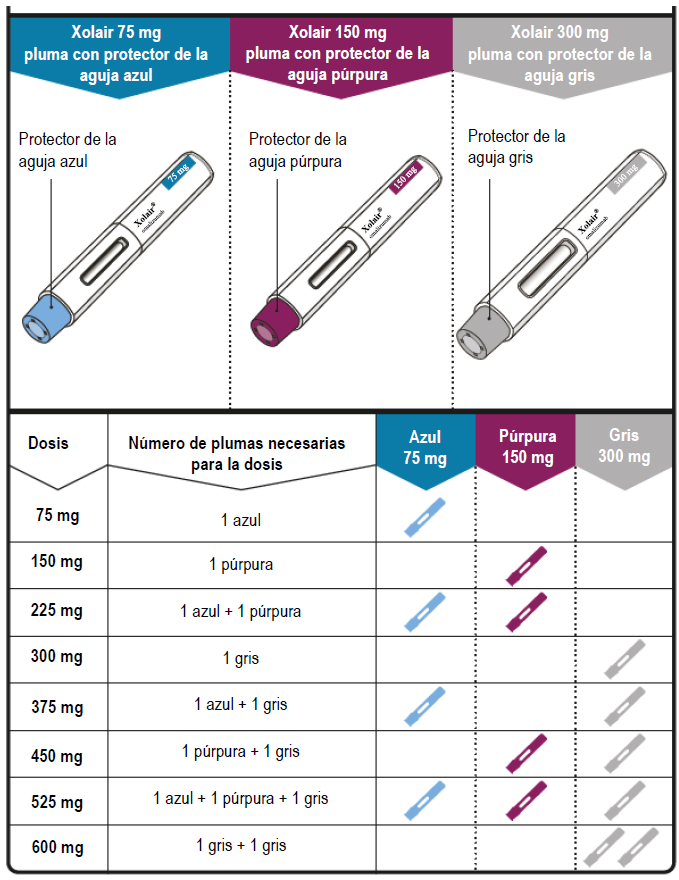
Preparación para la inyección de XOLAIR®
|
Paso 1. Lleve a temperatura ambiente Saque del refrigerador la caja que contiene la pluma precargada y déjela reposar sin abrirla para que alcance la temperatura ambiente (mínimo 30 minutos). Nota: Si necesita más de una pluma precargada (una pluma por caja) para administrar su dosis completa (ver Tabla de Dosificación), saque del refrigerador todas las cajas al mismo tiempo. |
|
|
Paso 2. Reúna el material necesario Necesitará el siguiente material (no incluido en la caja): · Toallita empapada en alcohol · Gasa o torunda de algodón · Recipiente para objetos punzantes Banda adhesiva |
|
|
Paso 3. Desempaque Retire la pluma precargada de la caja de cartón. No retire el capuchón hasta que esté listo para aplicar la inyección. |
|
|
Paso 4. Inspeccione la pluma precargada Mire a través de la ventana de inspección de la pluma precargada. El líquido del interior debe ser transparente o ligeramente turbio, y puede ser incoloro o levemente amarillo-parduzco. Es posible que vea burbujas de aire, pero eso es normal. · No utilice la pluma precargada si el líquido contiene partículas o si el líquido se ve claramente turbio o claramente marrón. · No utilice la pluma precargada si parece estar dañada. · No utilice la pluma precargada después de la fecha de caducidad, que está impresa en la etiqueta de la pluma precargada y en la caja. Ante cualquiera de estos casos, póngase en contacto con su médico. |
|
|
Paso 5. Elija el lugar de la inyección Debe aplicar la inyección en la parte delantera de los muslos o en la zona inferior del abdomen, pero no a menos de 5 cm del ombligo. No aplique la inyección en zonas de piel sensibles, contusionadas, enrojecidas, escamosas o duras, ni en zonas con cicatrices o estrías. Nota: Si necesita más de una pluma precargada para administrar su dosis completa, asegúrese de que las inyecciones están separadas al menos 2 cm. |
|
|
Si el cuidador, el médico o el enfermero aplica la inyección, también puede ponerse en la parte superior externa del brazo. |
|
Inyección con XOLAIR®
|
Paso 6. Limpie el lugar de la inyección Lávese las manos. Desinfecte el lugar de la inyección con una toallita empapada en alcohol. Deje secar la zona antes de aplicar la inyección. No toque ni sople la piel limpia antes de la inyección. |
|
|
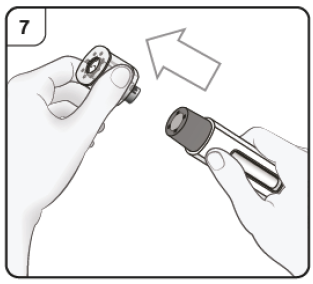
Paso 7. Retire el capuchón Tire del capuchón sin doblar la aguja en el sentido de la flecha. No vuelva a colocar el capuchón. Deseche el capuchón. |
|
|
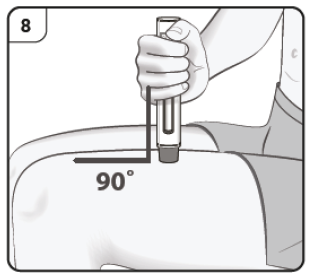
Paso 8. Posicione la pluma precargada Sujete la pluma precargada cómodamente con el protector de la aguja directamente contra la piel. La pluma debe colocarse en un ángulo de 90° con respecto a la piel, tal y como se muestra. |
|
|
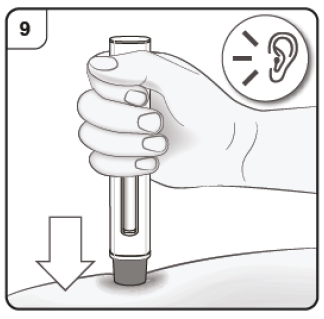
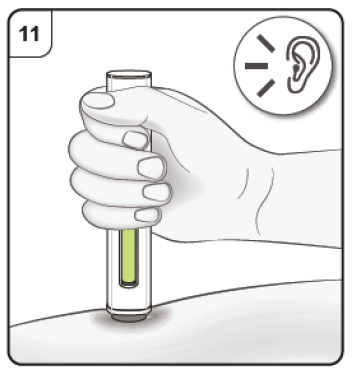
Paso 9. Inicie la inyección Presione y mantenga la pluma firmemente contra la piel. Preste atención al primer clic, que indica el inicio de la inyección. Esté pendiente de oír un «clic». |
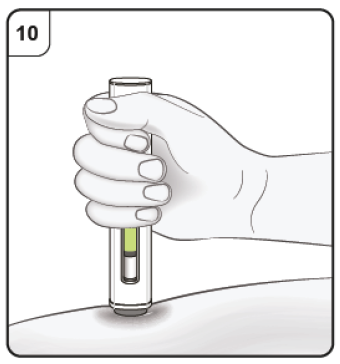
|
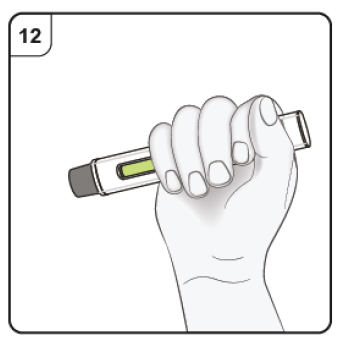
|
Paso 10. Continue la inyección Mantenga la pluma precargada firmemente presionada contra la piel. El indicador verde muestra el progreso de la inyección. |
|
|
Paso 11. Complete la inyección Esté pendiente de oír un segundo clic. Esto indica que la inyección casi ha acabado. Mantenga la pluma precargada en su lugar hasta que el indicador verde haya dejado de moverse para asegurarse de que la inyección ha finalizado. Retire la pluma precargada de la piel. El protector de la aguja cubre automáticamente la aguja. En este momento la inyección ha acabado. Esté pendiente de oír un “clic”. |
|
Después de la inyección
|
Paso 12. Revise el indicador verde Si el indicador verde no ha llenado completamente la ventana de inspección, póngase en contacto con su médico. Es posible que haya un poco de sangre en el lugar de la inyección. Puede presionar con una gasa o torunda de algodón el lugar de la inyección hasta que el sangrado se detenga. No frote el lugar de la inyección. Si es necesario, cubra el lugar de la inyección con una pequeña banda adhesiva. Nota: Si necesita más de una pluma precargada para administrar su dosis completa, deseche la pluma precargada usada tal y como se describe en el paso 13. Repita del paso 2 al paso 13 con todas las plumas precargadas necesarias para administrar la dosis completa. Aplique las inyecciones una inmediatamente después de otra. Asegúrese de que la separación entre inyecciones sea de al menos 2 cm. |
|
|
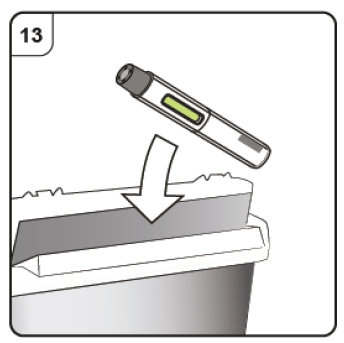
Paso 13. Deseche la pluma precargada Deposite la pluma precargada usada en un recipiente para objetos punzantes (es decir, en un recipiente resistente a la punción y con tapa, u otro similar) inmediatamente después de su uso. No tire la pluma precargada a la basura doméstica. Pregunte a su médico cómo desechar correctamente el recipiente para objetos punzantes. Es posible que exista una regulación local al respecto. |
|